Trastuzumab deruxtecan (T-DXd; DS-8201) in patients with HER2-positive advanced gastric or gastroesophageal junction (GEJ) adenocarcinoma: A randomized, phase II, multicenter, open-label study (DESTINY-Gastric01).
First Author : Kohei Shitara, et al.
HER2陽性進行胃癌と食道胃接合部癌に対するトラスツズマブ デルクステカン(T-DXd; DS-8201):無作為化第2相多施設共同非盲検試験(DESTINY-Gastric01試験)
背景
進行胃癌や進行食道胃接合部癌の約15から20%の症例でhuman epidermal growth factor receptor 2(HER2)の蛋白過剰発現または遺伝子増幅がみられる(Van Custem E, et al. Gastric Cancer. 2015)。このようなHER2陽性切除不能進行・再発胃癌/食道胃接合部癌に対する一次治療として、抗HER2抗体薬を併用した化学療法が推奨されているが、一次治療後に増悪した症例に対してHER2を標的とした薬物療法は現在のところ推奨されていない。また現状では、後次治療として承認されているイリノテカンやタキサン、トリフルリジン/チピラシル、ラムシルマブ、免疫チェックポイント阻害薬などの有効性も限定的である。
T-DXdは抗HER2抗体と切断可能なテトラペプチドベースのリンカー、トポイソメラーゼI阻害薬で構成される抗体薬物複合体である(図1)。
図1.T-DXdの構造
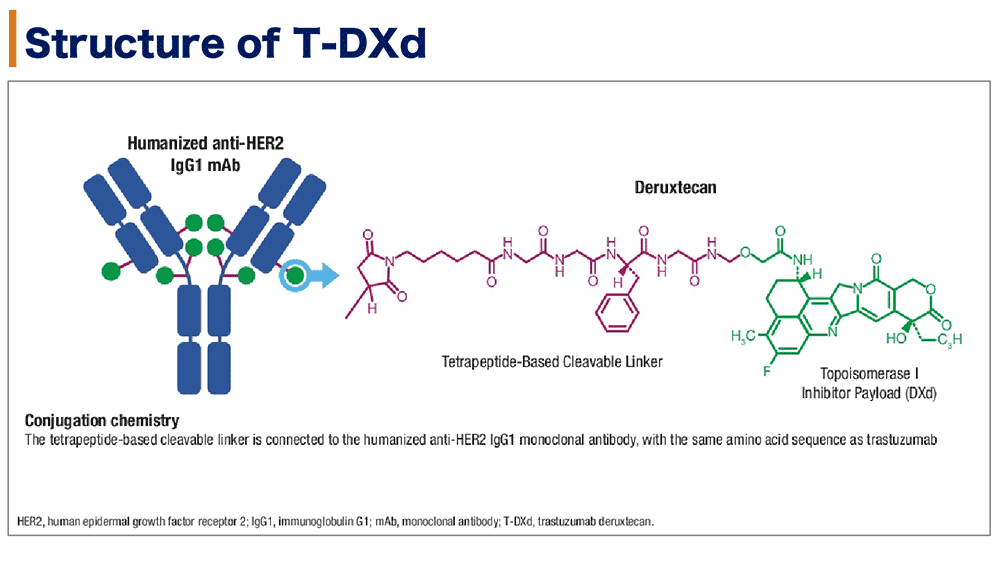
切除不能または遠隔転移を有するHER2陽性乳癌で、2レジメン以上の化学療法で増悪した症例を対象にT-DXdが近年米国にて承認された。44例のHER2陽性(IHC 3+またはIHC 2+/ISH +)進行胃癌と食道胃接合部癌を対象にしたT-DXd(5.4または6.4 mg/kg)の第1相試験(DS8201-A-J101; NCT02564900)では、奏効割合43.2%(19/44)、無増悪生存期間中央値は5.6か月が観察された。
対象と方法
DESTINY-Gastric01試験(DS8201-A-J202; NCT03329690)はHER2陽性進行胃癌と食道胃接合部癌に対してT-DXdを使用した多施設共同非盲検無作為化第2相試験である。収集された組織検体において中央判定にてHER2発現(IHC 3+、IHC2+/ISH+、IHC 2+/ISH-、またはIHC 1+)が確認された局所進行または切除不能進行胃癌・食道胃接合部癌で、少なくとも2レジメン(フルオロピリミジン、白金製剤、トラスツズマブまたはそのバイオシミラーを含む)以上の化学療法で増悪した症例を対象とした。今回はプライマリーコホートであるHER2陽性(IHC 3+、IHC 2+/ISH +)のデータを提示する。日本の48施設と韓国の18施設の計66施設から適格基準を満たした症例が登録され、T-DXd群(6.4 mg/kg q3w)とイリノテカンまたはパクリタキセルのPC(physician’s choice;治療医判断で選択)群とに2:1で無作為割り付けされた。病勢の悪化や許容できない有害事象、患者同意の取り下げなどが発生するまで治療が継続された。T-DXd(6.4 mg/kg)は3週毎に経静脈投与された。PC群ではイリノテカン(150 mg/m2)単剤を2週毎、またはパクリタキセル(80 mg/m2)単剤をday 1、day8、day 15の4週毎に投与された。
主要評価項目は中央判定による奏効割合(ORR:完全奏効[CR]+部分奏効[PR]、RECIST v1.1にて判定)とした。重要な副次評価項目として全生存(OS)の統計学的評価をおこない、その際主要評価項目が統計学的に有意性を示された場合には、サブグループ解析も行うこととした。その他の副次評価項目は、奏効期間(DOR)、無増悪生存(PFS)、病勢制御割合(DCR;完全奏効[CR]+部分奏効[PR]+安定[SD])、confirmed ORR(4週間以上持続)、そして安全性とした。ORRがPC群15%に対してT-DXd群40%となることを期待し、検出力92.9%、両側α0.05として180症例が必要された。さらに、ハザード比(HR)0.61を検出力80%、両側α0.05で検出するために、約133例のOSイベントが必要と考えた。
全症例で約24週後の腫瘍評価をおこなったか治療を中止した後に、中間解析としてOS評価が行われた。データカットオフは2019年11月8日だった。
