Trastuzumab deruxtecan (T-DXd; DS-8201) in patients with HER2-mutated metastatic non-small cell lung cancer (NSCLC): Interim results of DESTINY-Lung01.
First Author : Smit E, et al.
HER2遺伝子変異陽性転移性非小細胞肺がんにおけるTrastuzumab deruxtecan(T-DXd; DS-8201)単群第2相試験(DESTINY-Lung01試験)の中間解析結果
背景
T-DXdは、トラスツズマブと同じアミノ酸配列を持つヒト化抗HER2モノクローナル抗体、トポイソメラーゼI阻害剤であるエキセテカン誘導体(payload)、両者を結合させるためのテトラペプチドベースの切断可能リンカー、の3つの構成要素からなる新規の抗体薬物複合体(ADC)である。腫瘍細胞内での選択的な切断のためにリンカーの結合性が安定していること、遊離されたpayloadはトポイソメラーゼI阻害薬として強力な作用を発揮する一方で体内半減期は短いこと、抗体1分子に対するpayloadの比率が約8と高いこと、などがT-DXdの特徴とされている。
T-DXdは非小細胞肺がんを含む様々な固形腫瘍において開発が進んでおり、今回報告されたDESTINY-Lung01は、HER2発現またはHER2活性化変異を有する標準治療抵抗性の切除不能非扁平上皮非小細胞肺がん患者を対象とした非盲検多施設複数コホートの第2相試験である。
対象と方法
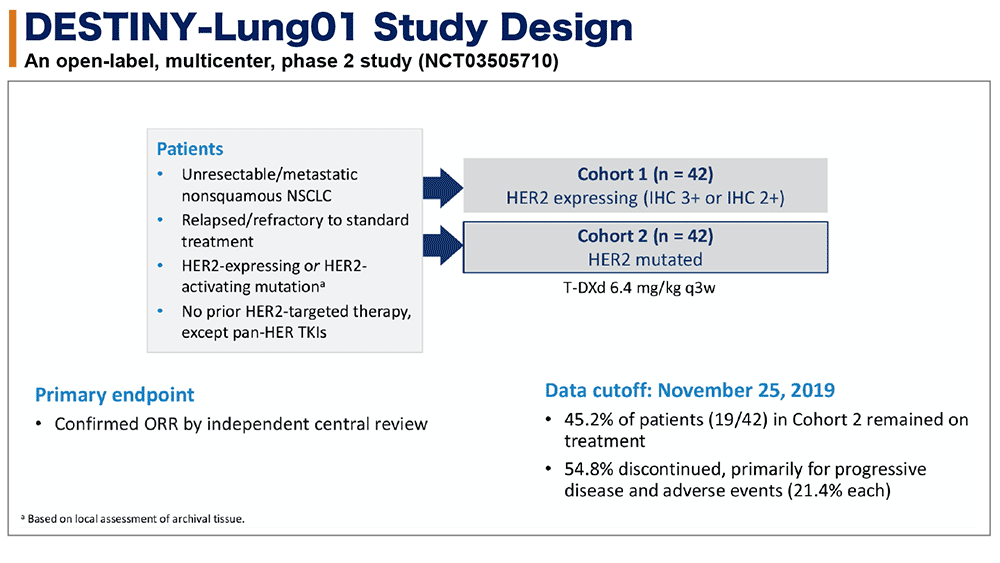
DESTINY-Lung01試験のデザインを図1に示す。今回はHER2免疫染色陽性例(HER2免疫組織染色スコア2+以上)のみを含むコホート1ではなく、HER2活性化変異例のみを含むコホート2の42例の結果が報告された。登録例は、T-DXd 6.4mg/kg 3週毎で治療された。Primary endpointは、独立中央判定による客観的奏効割合(ORR)だった。2019年11月25日のデータカットオフでは、コホート2登録例の45%が治療を継続し、54%が主に疾患増悪と有害事象のために試験治療を終了していた。
図1 試験のデザイン