A randomized study of temozolomide or temozolomide and capecitabine in patients with advanced pancreatic neuroendocrine tumors: Final analysis of efficacy and evaluation of MGMT as a predictive biomarker (ECOG-ACRIN E2211).
First Author : L. Pamela, et al.
ECOG-ACRIN E2211試験:進行膵神経内分泌腫瘍に対するテモゾロミド単剤とテモゾロミド+カペシタビン併用療法のランダム化比較第2相試験:最終解析での治療効果およびMGMTの予測マーカーとしての評価
背景
進行膵原発神経内分泌腫瘍(NETs)に対して腫瘍縮小効果が得られる治療レジメンは限定的である。膵NETsに対する殺細胞性抗がん剤としてはストレプトゾシンが唯一承認されているが、テモゾロミドの方が有害事象の少なさや経口バイオアベイラビリティが高い点において優れている。実際にテモゾロミドを用いた小規模の研究では高い奏効割合が報告されている。
テモゾロミドはDNAのグアニンの6位の酸素原子をメチル化することによりDNA損傷を引き起こし、細胞死を誘導するが、一方でMGMTによるDNA修復機構が働く。神経膠腫ではMGMT遺伝子のプロモーター領域のメチル化によってMGMTの発現・活性が低下すると、アルキル化剤に対して高い感受性を示すことが知られている。NETsにおいてはプロモーター領域のメチル化を認める頻度は少ないため、メチル化以外の機序によってMGMTの発現・活性が低下していると考えられる。膵NETsではMGMTが治療効果予測因子であるかは未だ明らかではない。
本試験ではテモゾロミド+カペシタビン併用療法の有効性を検討することを目的として実施された。同時にMGMTが治療効果予測因子であるかについても評価を行った。
対象と⽅法
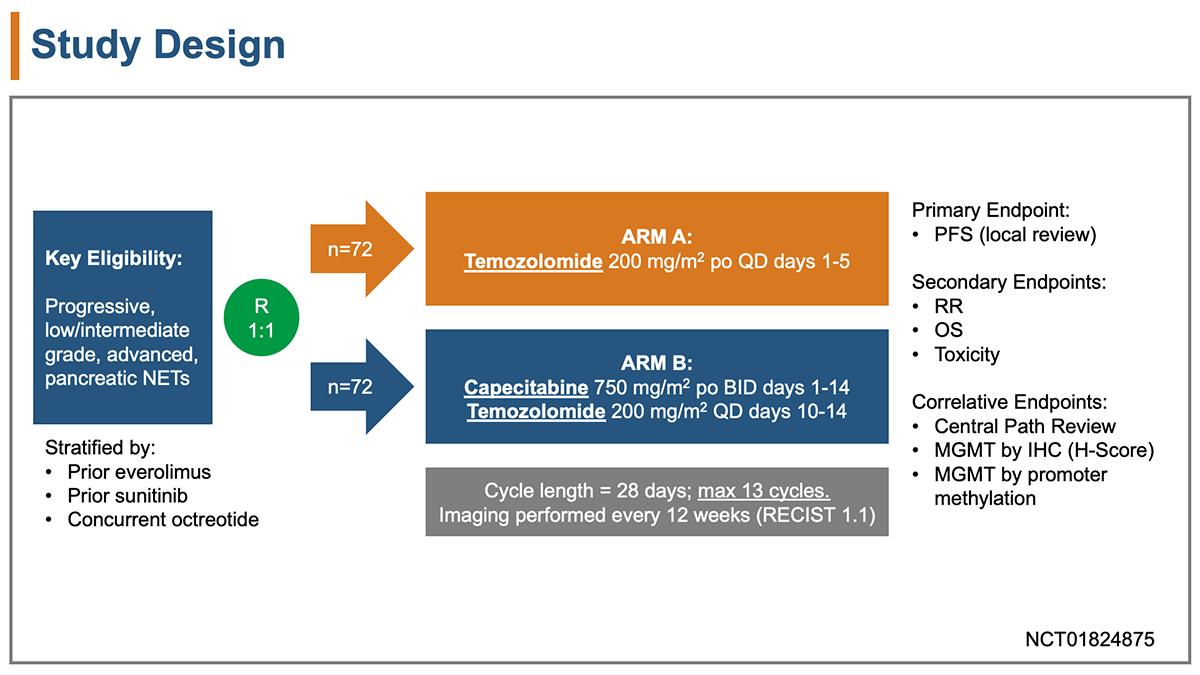
E2211試験は進行膵原発NETs患者を対象とし、テモゾロミド単剤群とテモゾロミド+カペシタビン併用療法群を比較する多施設共同ランダム化第2相試験である。
テモゾロミド単剤群ではDay1〜Day5まで5日間連続で1日1回200 mg/m2を経口投与、あるいはテモゾロミド+カペシタビン併用療法群ではDay1〜Day14まで14日間連続で1日2回カペシタビン750 mg/m2を経口投与、Day10〜Day14まで5日間連続で1日1回テモゾロミド200 mg/m2を経口投与された。いずれの群でも28日間を1サイクルとして、最大13サイクルまで治療を行うことと規定された。
対象は、主な適格規準として、①過去12ヶ月以内に病勢増悪を認め、②テモゾロミド、ダカルバジン、カペシタビン、5-FUによる治療歴がない、③転移性または切除不能の、④Grade 1またはGrade 2の膵原発NETs、とした。層別化因子は、エベロリムスによる前治療歴、スニチニブによる前治療歴、オクトレオチドの併用として、テモゾロミド単剤群とテモゾロミド+カペシタビン併用療法群に1:1にランダム化割り付けが行われた。
主要評価項目は、無増悪生存期間(PFS)、副次評価項目は、全生存期間(OS)、奏効割合、安全性、免疫組織化学染色(IHC)によるMGMTの発現やプロモーター領域のメチル化解析と設定された。
PFS中央値は、テモゾロミド単剤群9ヶ月に対してテモゾロミド+カペシタビン併用療法群14ヶ月、ハザード比0.64への改善を期待して、両側ログランク検定により必要症例数138例、5%の不適格例を見込んで全体で145例の登録予定と設定した(α=0.20、検出力81%)。なおPFSの中間解析は80例のイベントが生じた時点で実施し、O' Brien-Fleming法を用いて有意水準は0.119と規定された。中間解析は2018年1月に実施され、ASCO2018で発表された。今回最終解析が2021年5月時点で実施された。(図1)
図1 試験デザイン