Trastuzumab deruxtecan (T-DXd; DS-8201) in patients (pts) with HER2-expressing unresectable or recurrent biliary tract cancer (BTC): An investigator-initiated multicenter phase 2 study (HERB trial).
First Author : Akihiro Ohba, et al.
HERB試験:HER2陽性の切除不能または再発胆道癌に対するトラスツズマブ デルクステカンの医師主導多施設共同第2相試験
背景
胆道癌の治療選択肢は限られ、予後は不良である。ABC-02試験結果に基づき、ゲムシタビン・シスプラチン併用療法(GC療法)が標準的な一次薬物療法である。近年では、上記治療とデュルバルマブ併用による生存期間の延長が報告されている(TOPAZ-1試験)。
二次薬物療法では、FOLFOX療法およびナノリポソーマルイリノテカン+FF療法の予後延長効果が報告されている。しかしこれらの治療の客観的奏効割合は5-15%程度に留まる。
胆道癌に対しては複数の治療標的分子が報告されている。ヒト上皮増殖因子受容体2型(HER2)の胆道癌患者における発現割合は胆嚢癌で30%、肝外胆管癌で10-20%、肝内胆管癌で5%とされる。
トラスツズマブ デルクステカン(T-DXd)は抗HER2ヒト化モノクローナル抗体と切断可能なテトラペプチド系リンカー、およびトポイソメラーゼⅠインヒビターの複合体であり、HER2陽性乳癌・胃癌において予後延長効果が示されている。
HERB試験はHER2陽性胆道癌患者を対象としたT-DXdの多施設共同第2相試験である。
対象と⽅法
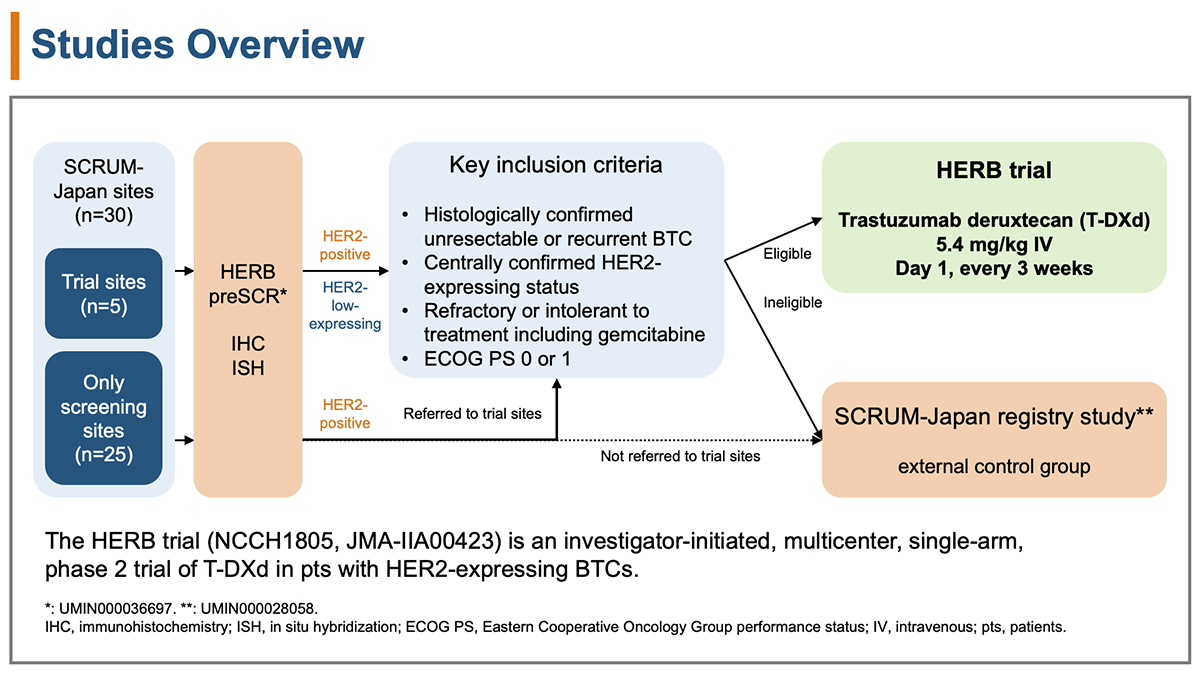
HER2の発現はHERB preSCR試験において中央病理学検査で確認した。HER2陽性はIHC3+またはIHC2+/ISH+、HER2低発現はIHC/ISHステータス0/+、1+/−、1+/+、2+/− のいずれかと定義した。
適格規準は、病理学的に切除不能ないし再発胆道癌と診断され、ゲムシタビンを含む薬物療法が抵抗性または不耐容である、ECOG PS 0-1、HER2発現が確認された患者とした。対象患者に対して3週毎に5.4mg/kgのT-DXdの投与を行った(図1)。
図1 症例フローチャート