Nimotuzumab Plus Gemcitabine versus Placebo plus Gemcitabine in K-Ras Wild type locally Advanced or Metastatic Pancreatic Cancer: A Prospective, Randomized-controlled, Double-blinded, Multicenter and Phase Ⅲ Clinical Trial
First Author : Shukui Qin, Jin Li, Yuxian Bai et al.
KRAS野生型の局所進行もしくは転移を有する膵癌に対するNimotuzumab+ゲムシタビンとプラセボ+ゲムシタビン:前向きランダム化二重盲検多施設共同第3相臨床試験
背景と目的
KRAS変異は膵癌で最もよく認められる遺伝子変異であり(アメリカ~90%、中国~87%)、ドライバー遺伝子として働く。KRAS野生型は膵癌の10~15%である。
Nimotuzumab(Nimo)は、ヒト化モノクローナル抗体であり、EGFRのリガンドへの結合を阻害する。特異的にEGFRのシグナル経路を阻害し、ADCC,CDCやその他の免疫効果を介してEGFRのエンドサイトーシスと分解を誘導する。そして進行膵癌に対しても有効な薬剤として受け入れられている。
ドイツで行われた第2相試験(PCD07)では、Nimotuzumab(Nimo)+ゲムシタビン群がプラセボ+ゲムシタビン群と比較し、局所進行や転移を有する膵癌(生存期間中央値: 8.6 vs. 6.0ヵ月)、特にKRAS野生型サブグループ(生存期間中央値: 11.62 vs. 5.67ヵ月)において生存期間を有意に改善させた。
NOTABLE試験は、KRAS癌遺伝子を事前にスクリーニングすることでKRAS野生型の患者を選択し、KRAS野生型の局所進行もしくは転移を有する膵癌患者に対するNimo+ゲムシタビンの有効性と安全性を評価することを目的とした第3相試験である。
対象と⽅法
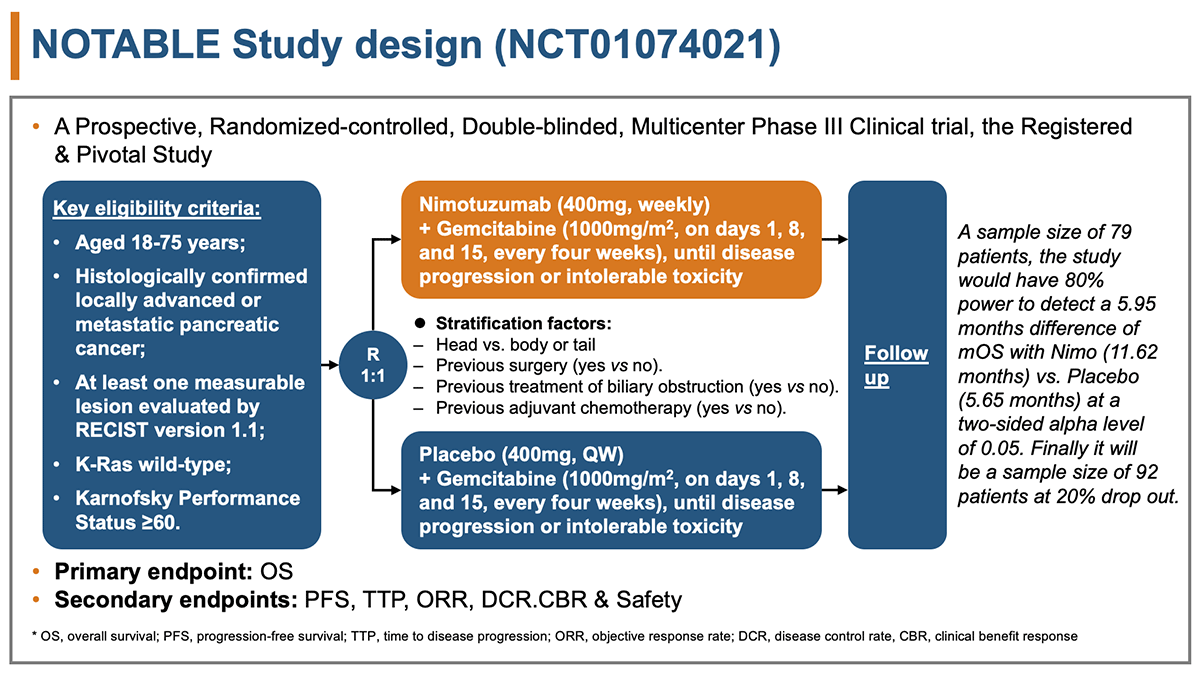
本試験の主な適格基準は、①組織学的に確定した局所進行もしくは転移を有する膵癌であること、②RECIST vesion1.1で評価される少なくとも1つの測定可能病変を有すること、③KRAS野生型などだった(図1)。
Nimo群ではNimo(400㎎、週一回)+ゲムシタビン(1000㎎/m2、day1、day8、day15を4週毎)、プラセボ群ではプラセボ(400㎎、週一回)+ゲムシタビン(1000㎎/m2、day1、day8、day15を4週毎)をがんの進行もしくは許容できない有害事象を認めるまで継続した。
症例数設定は、全生存期間の中央値をNimo群11.62か月とプラセボ群5.65か月と仮定し、中央値で5.95か月の違いを検出することとし、検出力80%、両側α0.05で算出したところ、79人が必要となった。20%の脱落を見込んで、必要症例数は、両群で92人となった。
Nimo群(Nimo+ゲムシタビン)とプラセボ群(プラセボ+ゲムシタビン群)に1:1にランダム化割付された。
主要評価項目は全生存期間(OS)であり、副次評価項目は無増悪生存期間(PFS)、無増悪期間(TTP)、奏効割合(ORR)、病勢制御割合(DCR)、臨床的有効性(CBR)、安全性だった。
図1 研究デザイン