IMbrave150: updated overall survival data from a global, randomized, open-label, Phase III study of atezolizumab + bevacizumab vs sorafenib in patients with unresectable hepatocellular carcinoma
First Author : Finn RS, et al.
IMbrave150試験: 切除不能肝細胞癌に対するアテゾリズマブ+ベバシズマブとソラフェニブを比較するグローバル、無作為化、オープンラベル第3相試験の全生存期間のアップデートデータ
背景
IMbrave150試験の初回中間解析において、アテゾリズマブ+ベバシズマブはソラフェニブに比べ、全生存期間(OS)ではアテゾリズマブ+ベバシズマブ;NE, ソラフェニブ; 13.2ヶ月、ハザード比0.58(95%信頼区間(CI): 0.42, 0.79), p<0.001、独立評価機関(IRF; independent review facility)によるRECIST v1.1評価による無増悪生存期間(PFS)ではアテゾリズマブ+ベバシズマブ; 6.8ヶ月, ソラフェニブ; 4.3ヶ月、ハザード比0.59(95%CI: 0.47, 0.76), p<0.001とco-primary endpointの双方で有意に良好な成績を示した。また、副次的評価項目である客観的奏効割合(ORR)については、RECIST v1.1評価およびmRECIST評価でアテゾリズマブ+ベバシズマブ/ソラフェニブはそれぞれ、27%/12%、33%/13%であり、ともにp<0.001でアテゾリズマブ+ベバシズマブはソラフェニブ比べ有意に良好だった。また、完全奏効(CR)は、アテゾリズマブ+ベバシズマブ/ソラフェニブはそれぞれ6%/0%、10%/2%に認められた。
観察期中央値8.6ヶ月の段階での解析であるが、アテゾリズマブ+ベバシズマブはソラフェニブに比べ、統計学的に有意かつ臨床的に有意義な改善をもたらしている。
今回、フォローアップ期間を12ヶ月延長し、観察期中央値15.6ヶ月のアプデートデータを報告する。
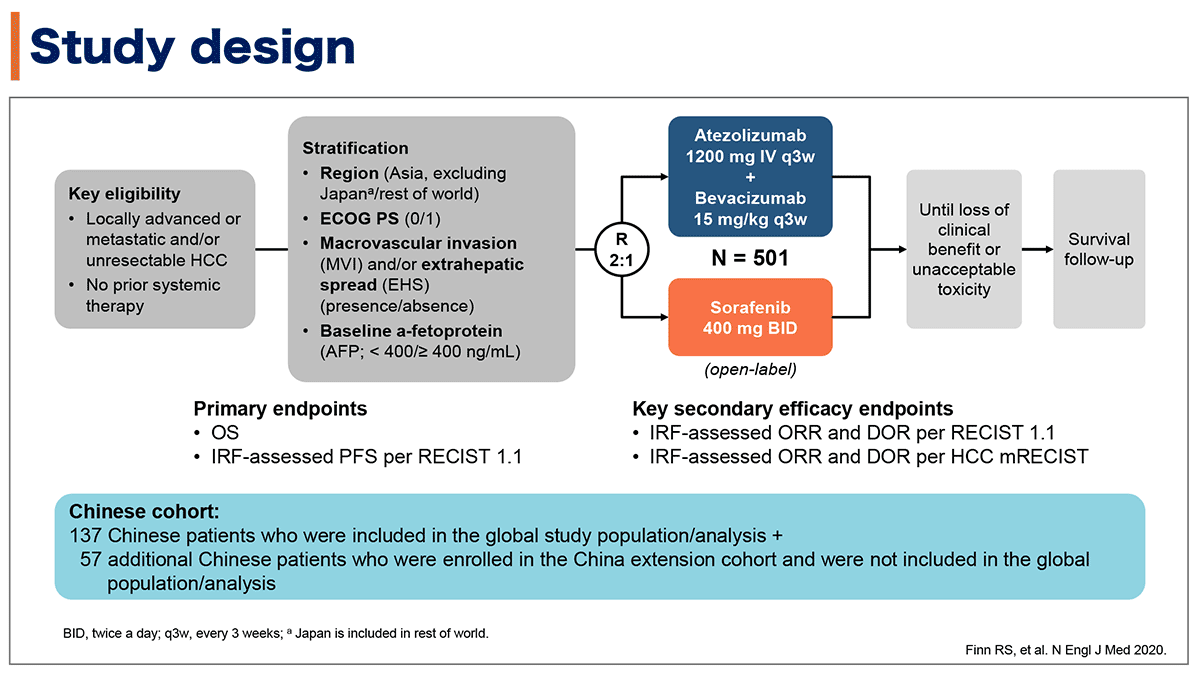
対象と方法
IMbrave150試験の対象は、全身化学療法歴の無い切除不能肝細胞癌患者であり、アテゾリズマブ+ベバシズマブをソラフェニブ2:1に割り付けられた。
主要評価項目はOS、PFS[RECIST v1.1 IRF評価]で、keyとなる副次的評価項目はRECIST v1.1/mRECISTに基づくIRFによるORRと奏効期間(DoR)などだった。
また、IMbrave150試験に登録された中国人患者137名に加え中国拡大コホートで登録された57名の計194名のChinaコホートの解析も行われた。
2020年8月31日データカットオフ時点で観察期間中央値は15.6ヶ月、試験中の患者はアテゾリズマブ+ベバシズマブは136例(40%)、ソラフェニブは43例(26%)だった。また、試験中止例はアテゾリズマブ+ベバシズマブで200例(60%)、ソラフェニブは122例(74%)であり、死亡はアテゾリズマブ+ベバシズマブで179例(53%)、ソラフェニブは99例(60%)だった(図1)。
図1. 試験デザイン