A Phase 2 Randomised, Double-Blind, Placebo-Controlled Study of Bevacizumab in Combination Qith Atezolizumab and Gemcitabine/Cisplatin in Patients With Advanced Biliary Tract Cancer: IMbrave151
First Author : A. EI-Khoueiry, et al.
進行胆道癌に対するゲムシタビン+シスプラチン+アテゾリズマブ併用療法にベバシズマブの上乗せ効果を検討する無作為化二重盲検プラセボ対照第2相試験:IMbrave151試験
背景と目的
進行胆道癌は限られた治療選択肢しかなく、予後不良である。TOPAZ-1試験において、ゲムシタビン+シスプラチン(GC)+デュルマルマブ併用療法はGC療法に対してOSを有意に延長し、標準的な一次薬物療法となった。
一方、VEGF阻害薬は細胞傷害性抗癌剤と組み合わせることで、腫瘍免疫微小環境の免疫寛容を回復し、PD-L1阻害の効果を高めると考えられている。アテゾリズマブ(抗PD-L1抗体)とベバシズマブ(抗VEGF抗体)の併用療法は切除不能肝細胞癌に対して世界的に標準的な一次薬物療法である。非小細胞肺癌においても、プラチナ併用化学療法とアテゾリズマブ+ベバシズマブの併用療法は一次薬物療法の選択肢となっている。
進行胆道癌に対してGC療法とアテゾリズマブ(抗PD-L1抗体)にベバシズマブ(抗VEGF抗体)を併用することを検討したIMbrave151試験の結果がASCO-GI 2023にて報告された。
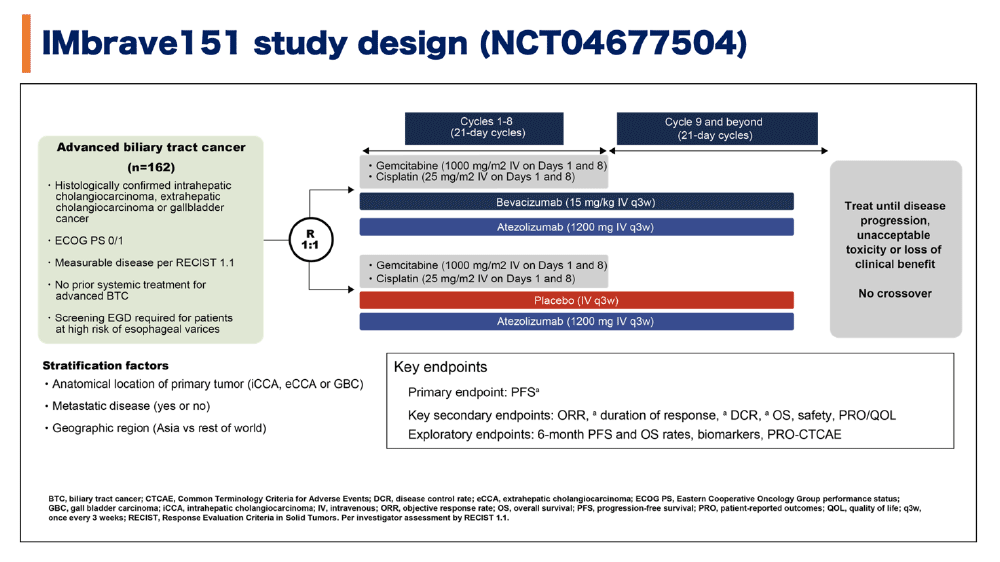
対象と方法
IMbrave 151試験は、進行胆道癌の一次治療としてGC療法とアテゾリズマブ(抗PD-L1抗体)にベバシズマブ(抗VEGF抗体)を併用することを検討した無作為化二重盲検プラセボ対照多施設国際共同第2相試験である(図1)。主な適格基準は①18歳以上、②組織学的に肝内胆管癌、肝外胆管癌、胆嚢癌と診断されている、③CTもしくはMRIで切除不能、再発・転移胆道癌と診断されている、④評価可能病変がある、⑤前治療歴がない、⑥ECOG PS 0-1、などであった。
患者はベバシズマブ 15 mg/kg、アテゾリズマブ 1200 mgを3週毎に投与し、ゲムシタビン 1000 mg/m2 , シスプラチン 25 mg/m2 を3週毎(day1, day8に投与)に8サイクルまで投与する群(ベバシズマブ併用群:Atezo+Bev+GC)と、ベバシズマブの代わりプラセボを投与する群(プラセボ群:Atezo+PBO+GC)のいずれかに1:1で無作為に割り付けられた。原発巣の部位(肝内胆管癌、肝外胆管癌、胆嚢癌)、遠隔転移の有無、地域(アジアかその他の地域)によって層別化された。
主要評価項目はRECIST v1.1による無増悪生存期間(PFS)、主要副次的評価項目は客観的奏効率(ORR)、奏効期間(DOR)、病勢制御率(DCR)、全生存期間(OS)、安全性、患者報告アウトカム(PRO)およびQOLであった。探索的評価項目として、6ヶ月時点のPFS/OS率などが設定された。有効性の検出力は設定されなかった。
図1 試験デザイン