NAPOLI 3: A randomized, open-label phase 3 study of liposomal irinotecan + 5-fluorouracil/leucovorin + oxaliplatin(NALIRIFOX) versus nab-paclitaxel +gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma
First Author : Zev A. Wainberg, et al.
未治療の転移性膵管腺癌 (mPDAC) 患者におけるliposomal irinotecan + + 5-fluorouracil/leucovorin + oxaliplatin (NALIRIFOX)と nab-paclitaxel + gemcitabineの無作為化非盲検第3相試験(NAPOLI-3)
背景
膵癌は進行性の全身性疾患であり、発症率は増加しており、2030年までにがんに関連する死因として2番目に多くなることが予想されている。
ゲムシタビンベースの治療で増悪を認めた転移性膵癌に対し、5-fluorouracil/leucovorin(5-FU/LV)併用リポソームイリノテカン投与が米国と欧州、アジアで承認されている。
第1/2相試験では、リポソームイリノテカン+5-FU+LV+oxaliplatin (NALIRIFOX)の転移性膵癌患者に対する有効性が示された。
ここで、転移性膵癌患者の初回治療として、NALIRIFOXとnab-パクリタキセル+ゲムシタビンの有効性と安全性を比較検討した無作為化非盲検第3相試験NAPOLI-3の結果を報告する。
対象と方法
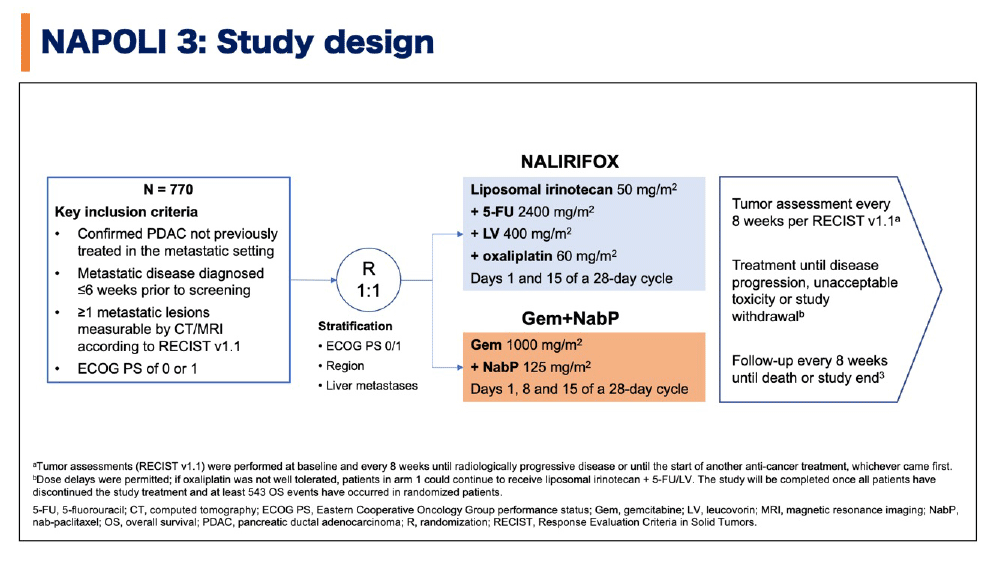
病理組織学的/細胞学的に確認された転移性膵癌の初回治療例を対象として、NALIRIFOX群とnab-パクリタキセル+ゲムシタビン群に1:1の割合で無作為に割り付けた。NALIRIFOXはリポソームイリノテカン50mg/m2、5-FU 2400mg/m2、LV 400mg/m2、oxaliplatin 60mg/m2を1日目と15日目、28日サイクルにて投与された。nab-パクリタキセル+ゲムシタビンは、nab-パクリタキセル125mg/m2とゲムシタビン1000mg/m2を1、8、15日目、28日サイクルにて投与された。ECOG PS、地域、肝転移の有無によって層別化された。主要評価項目は全生存期間(OS)、副次評価項目は無増悪生存期間(PFS)、奏効率(ORR)、安全性とした。
図1