A phase II study of trifluridine/tipiracil and ramucirumab in patients with unresectable advanced or recurrent gastric cancer.
First Author : Ando T, et al.
切除不能進行/再発胃癌に対するFTD/TPI+ラムシルマブの第2相試験
背景
胃癌は世界で5番目の罹患数、3番目の死亡数のがん種である。進行胃癌の二次治療としてパクリタキセル+ラムシルマブ(抗VEGFR2モノクロナール抗体)が最も推奨されている1)。
トリフルリジン/チピラシル塩酸塩(FTD/TPI)はチミジン類似体であるトリフルリジンと、トリフルリジンの分解を防ぐチピラシル塩酸塩を配合した経口剤である。FTD/TPIは国際共同第3相試験(TAGS試験2))の結果より、米国、欧州、東アジアにおいて進行胃癌に対する後方ラインの治療として承認された。
FTD/TPIと抗VEGF-A抗体薬であるベバシズマブの併用療法は転移性大腸癌症例において良好な有効性と安全性が報告されている(C-TASK FORCE3)/Danish trial4)/TASCO15))。
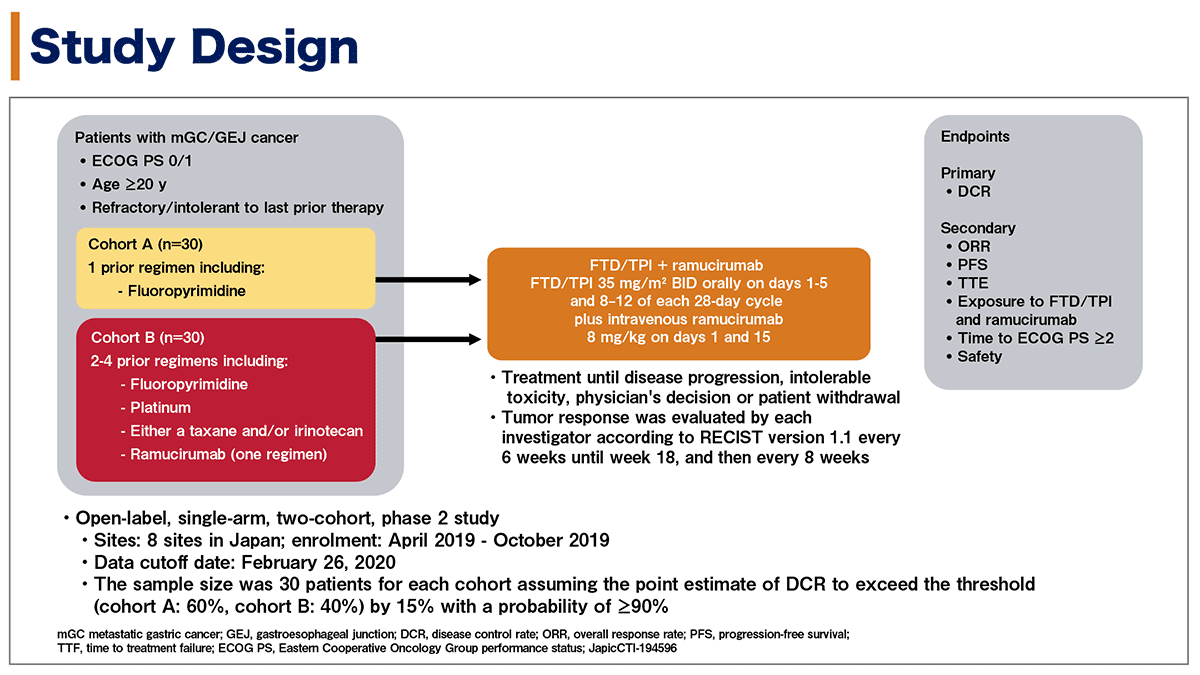
本試験はフッ化ピリミジン系薬剤に不応または不耐となった進行再発胃癌/胃食道接合部癌患者の2次治療と3次治療以降のそれぞれ2つのコホートの患者に対する、FTD/TPI+ラムシルマブ併用療法の有効性と安全性を探索する単アーム非盲検第2相試験である。
対象と方法
主な患者組み入れ基準はECOG PS 0-1、年齢20歳以上で、直近の前治療に不応/不耐となった転移性胃癌/胃食道接合部癌とされた。更にコホートAはフッ化ピリミジン系薬剤を含んだ1レジメンの前治療歴のある症例を、コホートBはフッ化ピリミジン系薬剤、プラチナ製剤、タキサン系薬剤/イリノテカンのいずれか、もしくは両者、ラムシルマブ(1レジメンのみ)を用いた2-4レジメン以上の前治療歴のある症例を対象とした。
FTD/TPIは35mg/m2(1日2回)を1日目〜5日目、8日目〜12日目に内服し、これを28日毎に繰り返した。ラムシルマブは8mg/kgを1日目、15日目に点滴静注された。
主要評価項目は、コホートA、Bともに病勢制御割合(DCR)であり、副次的評価項目は客観的奏効割合(ORR)、無増悪生存期間(PFS)、治療成功期間(TTF)、FTD/TPIとラムシルマブの暴露量、ECOG PS 2以上になるまでの期間、安全性であった。
図1. 試験デザイン