A phase II, multicenter, open-label study of trastuzumab deruxtecan (T-DXd; DS-8201) in patients (pts) with HER2-expressing metastatic colorectal cancer (mCRC): DESTINY-CRC01.
First Author : Takayuki Yoshino, et al.
HER2発現の切除不能大腸癌に対するトラスツズマブ デルクステカン(T-DXd; DS-8201)の多施設共同非盲検化第2相試験(DESTINY-CRC01)
背景
トラスツズマブ デルクステカン(T-DXd)はトラスツズマブと同じアミノ酸配列からなるヒト化抗HER2 IgG1モノクローナル抗体とトポイソメラーゼ1阻害薬(カンプトテシンの新規誘導体(であるMAAA-1181a)、およびそれをつなぐ役割のテトラペプチドベースの切断可能なリンカーの3つの要素からなる抗体薬物複合体(ADC)である。近年多くの癌腫に対しADCの有用性が報告されており、既に本邦では化学療法歴を有するHER2陽性の手術不能または再発乳がん、胃がんに対して承認が得られている。今回、HER2発現のある切除不能大腸癌を対象として、T-DXdの有効性と安全性を検討した国際共同第2相試験(DESTINY-CRC01)試験の解析結果がASCO2020に引き続き報告された(本報告での追加・強調部分などを太字で示す)。
対象と方法
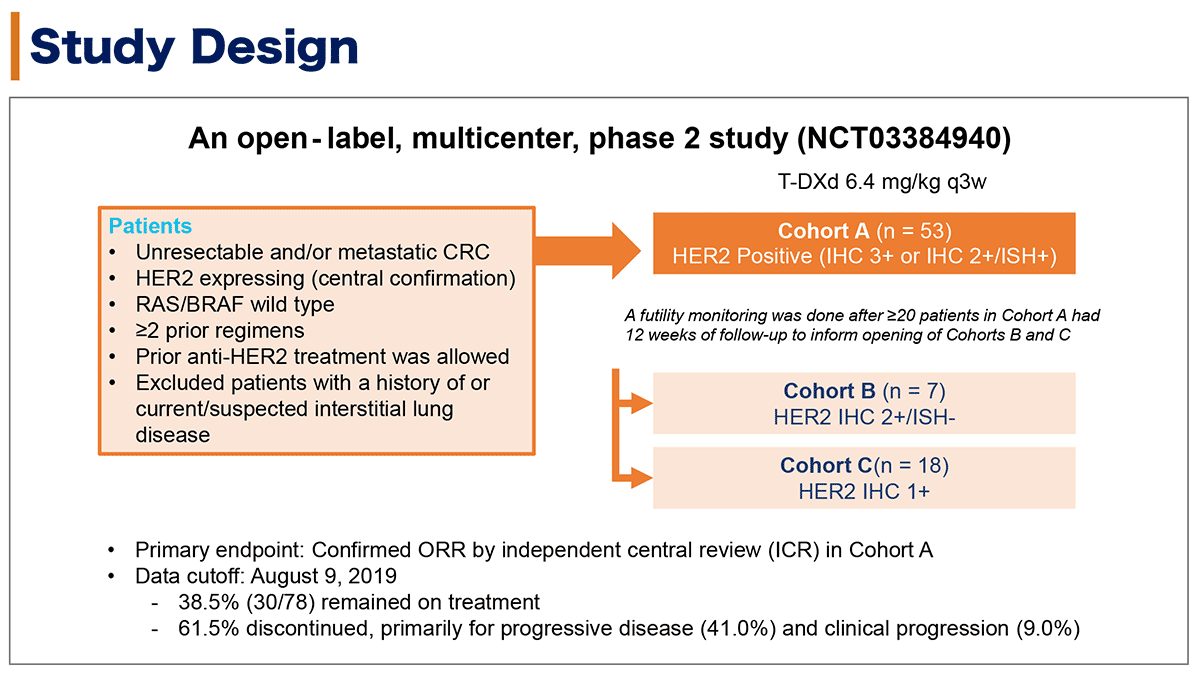
本試験の対象は、中央判定においてHER2発現の確認された切除不能大腸癌であり、主な適格基準はRAS/BRAF野生型、2レジメン以上の治療歴を有する症例であり、抗HER2療法の治療歴は許容された。一方で間質性肺疾患の既往歴がある症例/疑いのある症例は除外された(図1)。
T-DXdは6.4mg/kgを3週毎に不応・不耐となるまで投与された。
コホートAはHER2陽性例(免疫染色[IHC]3+ or IHC2+/in situハイブリダイゼーション法[ISH]+)とし、少なくとも20例の症例が12週後の腫瘍評価を完了した後に無益性のモニタリングを実施し、コホートB(IHC2+/ISH-)、コホートC(IHC1+)の登録開始が判断された。モニタリングの結果、コホートB/コホートCの登録開始が決定され、最終的にコホートA 53例、コホートB 7例、コホートC 18例が登録された。
本試験の主要評価項目はコホートAにおける中央判定での奏効割合(ORR)であった。
本解析のデータカットオフは2019年8月9日であり38.5%の症例は治療継続中であった。61.5%は試験治療を中止しており、その中止理由は原病増悪が41.0%、臨床的増悪が9.0%であった。
図1. 試験デザイン