Sintilimab plus bevacizumab biosimilar vs. sorafenib as first-line treatment for advanced hepatocellular carcinoma (ORIENT-32)
First Author : Zhenggang Ren
進行肝細胞癌の一次治療としてのsintilimab+ベバシズマブバイオシミラー vs. ソラフェニブ(ORIENT-32)
背景
切除不能肝細胞癌の一次治療として、これまで分子標的薬であるソラフェニブやレンバチニブが標準治療であるが、IMbrave 150試験においてアテゾリズマブ(抗PD-L1抗体)+ベバシズマブ併用療法がソラフェニブに対して優越性を示したため、本療法も標準治療として位置づけられることとなった。抗PD-1抗体であるsintilimabとベバシズマブのバイオシミラーの併用療法は、先行の第II相試験では、9ヶ月の観察期間で全生存期間(OS)は中央値に届かず、無増悪生存期間(PFS)中央値は8.4ヶ月だった。今回、全身薬物療法未施行の切除不能肝細胞癌を対象にsintilimab+ベバシズマブバイオシミラー併用療法とソラフェニブを比較した無作為化第III相試験の結果を報告する。
対象と方法
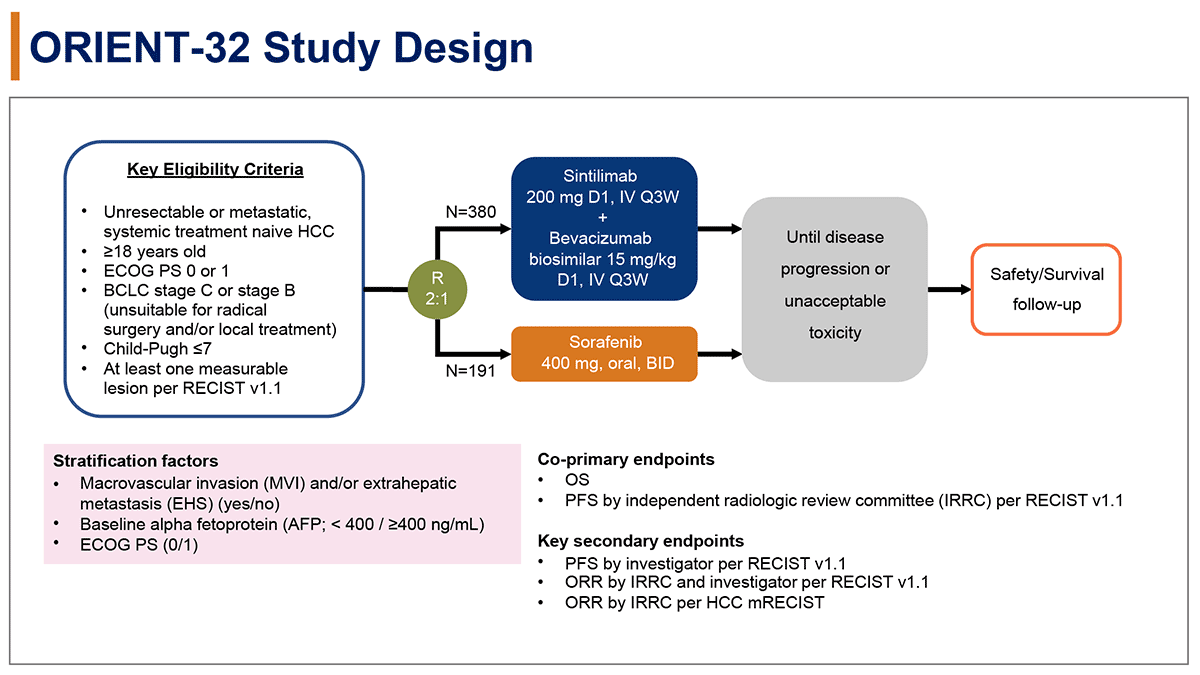
主な適格基準は、切除不能または遠隔転移を有する全身薬物療法未施行の肝細胞癌、Barcelona Clinic Liver Cancer (BCLC) 分類 stage Cまたはstage B、Child-Pugh 分類7点以下、Eastern Cooperative Oncology Group performance status (ECOG PS) 0/1とした。
sintilimab+ベバシズマブバイオシミラー併用群(Sin+Bev群)では、sintilimab 200mgとベバシズマブバイオシミラー 15mg/kgを3週ごとに経静脈投与し、ソラフェニブ群(Sor群)ではソラフェニブ1回400mgを1日2回内服とした。Sin + Bev群とSor群に2:1で無作為割り付けし、層別化因子は、主要血管浸潤/肝外転移の有無、AFP (<400 or ≥400 ng/mL)、ECOG PS 0 or 1とした。
主要評価項目はOSと、独立判定委員会の判定によるPFSとした。副次評価項目は、担当医の判定によるPFS、独立判定委員会および担当医の判定によるRECIST (Response Evaluation Criteria in Solid Tumor) v1.1に基づいた奏効割合、独立判定委員会の判定によるmodified RECISTに基づいた奏効割合であった。本解析のデータカットオフは2020年8月に行われた。(図1)
図1. 試験デザイン