Abstract LBA11
Randomised efficacy and safety results for atezilizumab + bevacizumab in patients with hepatocellular carcinoa.
First Author : Michael S Lee, et al.
背景
転移性食道がんにおいては、扁平上皮がんが~90%と多く、相対的5年生存率は8%以下と予後不良である。食道扁平上皮がんの最近の二次化学療法オプションは、生存期間が不良であり、有害事象も問題となる。これまでに、標準治療に不応/不耐となった進行性食道扁平上皮がんを対象とした第II相試験(ATTRACTION-1試験)が実施され、PD-1抗体であるニボルマブの良好な抗腫瘍効果と安全性が報告されている1)。
今回、1レジメンのフッ化ピリミジン+プラチナ製剤併用療法に不応/不耐となった切除不能進行/再発食道扁平上皮がんを対象として、標準化学療法(ドセタキセルまたはパクリタキセル)とニボルマブを比較検討した非盲検無作為化比較第III相試験(ATTRACTION-3)試験の最終解析結果が報告された。
対象と方法
本試験の対象は、切除不能進行/再発食道扁平上皮がんで、ECOG PS(performance status) 0-1、前治療として1レジメンのフッ化ピリミジン+プラチナ併用療法に不応/不耐な症例とされた。症例はニボルマブ(240mg 2週毎に点滴静注)もしくは化学療法(ドセタキセル 75mg/㎡ 3週毎に点滴静注 もしくは パクリタキセル 100mg/㎡ 6週連続で点滴静注後に1週休薬)に1:1で無作為割付けされた。層別因子は、地域、転移臓器個数、PD-L1発現の有無であった。(図1)
図1
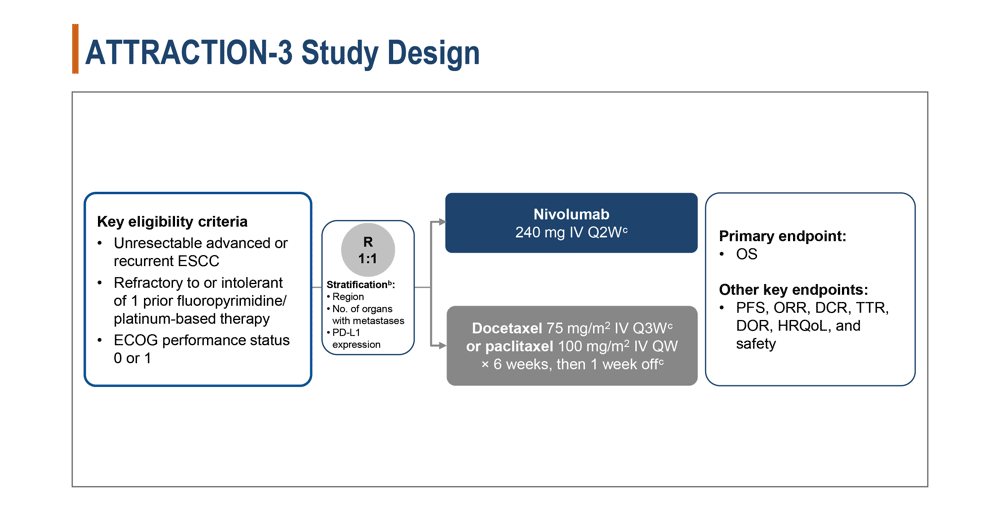
本試験の主要評価項目は全生存期間(OS)、他の重要な評価項目は無増悪生存期間(PFS)、奏効率(ORR)、病勢制御率(DCR)、奏効までの期間(TTR)、奏効期間(DOR)、健康関連QOL(HRQoL)、安全性とされた。
419例が無作為割付され、417例が割り付けられた治療を1回以上受けた。本解析のデータカットオフは2018年11月であり、最短の観察期間は17.6ヶ月であった。
