Randomized phase 3 ANGEL study of rivoceranib (apatinib) + best supportive care (BSC) vs placebo + BSC in patients with advanced/metastatic gastric cancer who failed ≥2 prior chemotherapy regimens.
First Author : Kang Y-K, et al.
背景
VEGFR-2に高い選択性を有した経口のチロシンキナーゼ阻害剤であるRivoceranib (Apatinib/YN968D1)は、進行胃がんに対する後方ライン(3次治療以降)での治療効果を検証する第III相試験において有意な生存期間の延長を示し1)、中国では既に承認済みの薬剤である。また、韓国と米国で行われた第I/II相試験にてRivoceranibの推奨投与量が決定され、中国以外の胃がん患者に対する期待される有効性も示されたが、国際共同無作為化比較試験は行われていなかった。よって、今回、アジア/北米/欧州における進行胃がん症例を対象に多施設国際共同二重盲検プラセボ対照無作為化第III相試験(ANGEL試験)が実施された。
対象と方法
本試験の対象は、進行/転移性の胃/食道・胃接合部腺がんで、ECOG PS 0-1、2ライン以上の化学療法に不応となった症例とされた。割付層別因子は地域(アジア vs 北米/欧州)、測定可能病変の有無、ラムシルマブ投与歴の有無、登録時の治療ライン(3次治療 vs 4次治療以降)であった。適格症例は2:1の割合でRivoceranib (700mg経口)+ベストサポーティブケア(BSC)群とプラセボ+BSC群に無作為割付けされた。主要評価項目は全生存期間(OS)、副次評価項目は無増悪生存期間(PFS)、奏効率(ORR)、病勢制御率(DCR)、QOL評価、安全性とされた。(図1)
図1
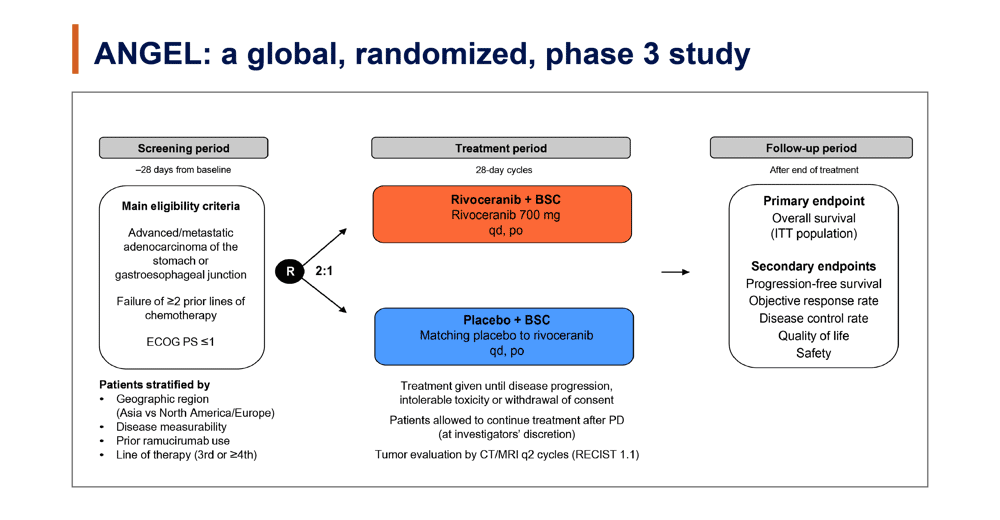
統計学的設定はプラセボ+BSC群の生存期間中央値を4.7ヶ月、Rivoceranib+BSC群の生存期間中央値を6.5ヶ月(HR=0.72)とし、両側α=0.05、検出力 80%で優越性を示す仮説で行われた。325イベントが必要とされ、登録必要症例数が459症例と算出された。
