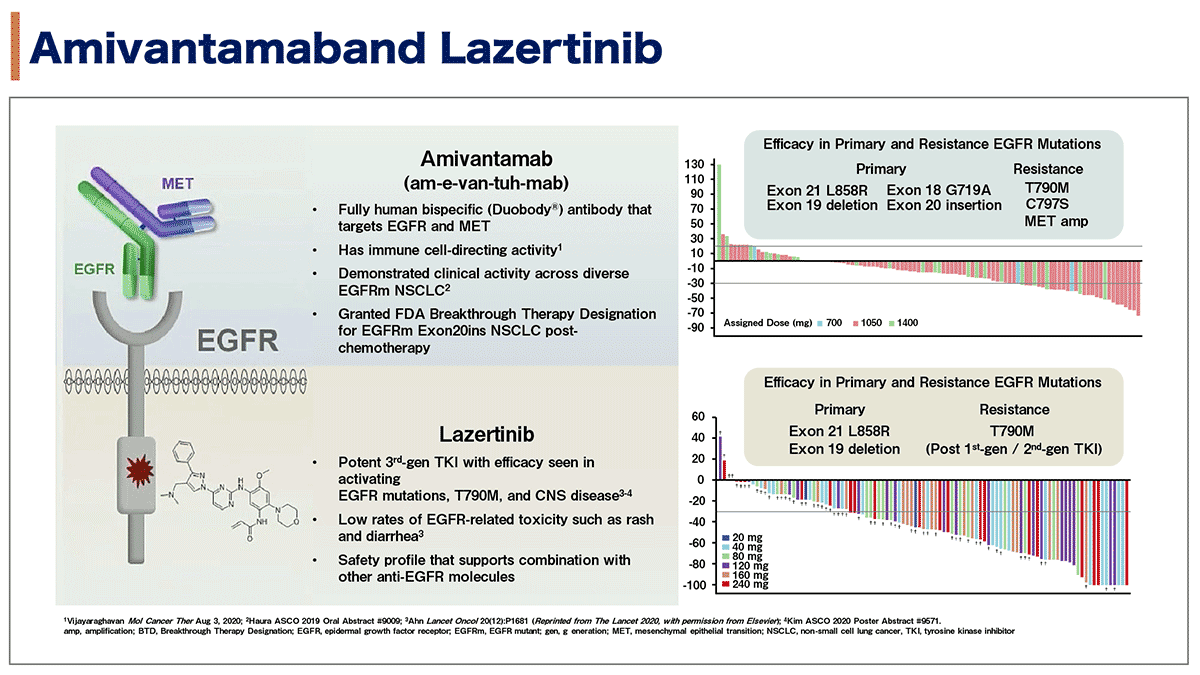
Amivantamab (JNJ-61186372), an EGFR-MET bispecific antibody, in combination with lazertinib, a 3rd-generation tyrosine kinase inhibitor (TKI), in advanced EGFR NSCLC
First Author : Cho Byoung
進行EGFR非小細胞肺癌患者に対するEGFR-MET二重特異的抗体Amivantamabと第三世代チロシンキナーゼ阻害剤lazertinibの併用療法
背景
AmivantamabはEGFRとMETに対する二重特異的抗体で免疫細胞に対して直接的な活性を有している。EGFR遺伝子変異陽性非小細胞肺癌(NSCLC)に対して臨床活性を有することが示されている。lazertinibは活性化EGFR遺伝子T790M変異陽性NSCLC患者や中枢神経系転移を有する患者に対して有効性が示されている第3世代のEGFRチロシンキナーゼ阻害剤である。EGFRに特有の皮疹や下痢などの副作用の頻度が少ないことが報告されており、他の抗EGFR分子との併用が可能な安全性プロファイルを有している。Cho氏らは、進行EGFR非小細胞肺癌患者に対するEGFR-MET二重特異的抗体Amivantamabと第三世代チロシンキナーゼ阻害剤lazertinibの併用療法の結果を報告した。
図1. マミバンタマブとlazertinib
対象と方法
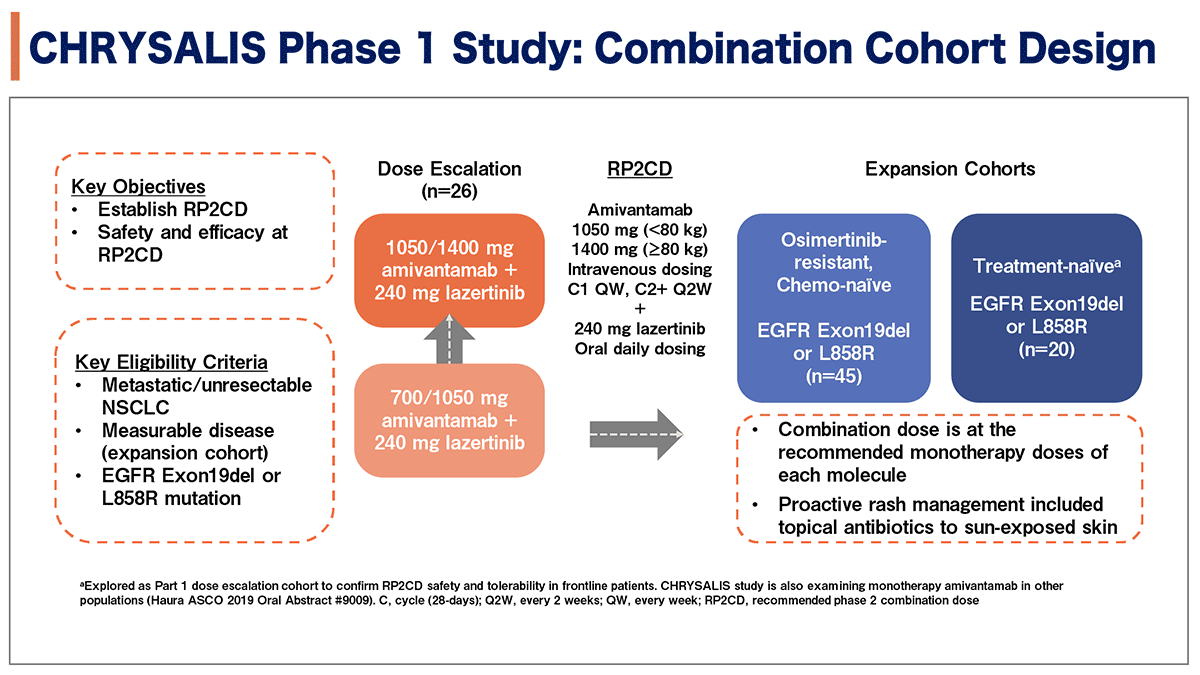
CHRYSALIS試験の第1相試験は、主要評価項目を第2相試験における併用療法の推奨用量の決定と推奨用量における安全性、有効性に設定し実施された(図2)。EGFRエクソン19欠失変異またはL858Rの変異を有する切除不能/転移性NSCLC患者26名が、Amivantamab700/1050㎎+lazertinib240㎎からAmivantamab1050/1400㎎+lazertinib240㎎に用量を漸増した用量漸増コホートに登録された。用量制限毒性が見られなかったため、第2相試験における併用療法の推奨用量はAmivantamab1050㎎(80㎏未満)および1400㎎(80㎏以下)+lazertinib240㎎に決定された。拡大コホートとしてオシメルチニブ耐性後の化学療法未施行例(45例)と未治療例(20例)が登録された。
図2. 試験デザイン