The Canadian Cancer Trials Group PA.7 Trial: Results of a Randomized Phase II Study of Gemcitabine (GEM) and Nab-Paclitaxel (Nab-P) vs. GEM, Nab-P, Durvalumab (D) and Tremelimumab (T) as First Line Therapy in Metastatic Pancreatic Ductal Adenocarcinoma (mPDAC)
First Author : Renouf D
カナダ癌試験グループPA.7試験:遠隔転移を有する膵管状腺癌に対する一次治療としてのGemcitabine+Nab-Paclitaxel療法とGemcitabine+Nab-Paclitaxel+Durvalumab+Tremelimumab療法を比較した第Ⅱ相無作為化試験
背景
遠隔転移を有する膵管状腺癌(mPDAC)に対する標準的一次治療にはGemcitabine(GEM)+Nab-Paclitaxel (Nab-P)療法、FOLFIRINOX療法がある1,2)。免疫チェックポイント阻害薬はミスマッチ修復機能欠損(deficient mismatch repair:dMMR)を有するPDAC以外では効果が乏しい3,4)。免疫抵抗性のメカニズムにはがん関連線維芽細胞や他の腫瘍微小環境が関与しており、GEM+Nab-Pによりがん関連線維芽細胞が減少する可能性がある5,6,7)。Durvalumab (D)は抗PD-L1抗体であり、Tremelimumab (T)は抗CTLA-4抗体である。第Ib相試験においてD+T併用療法の安全性が示された8)。mPDAC患者11人を対象としたGEM+Nab-P+D+T療法のSafty run-inパートでは、毒性としての問題を認めなかった9)。
対象と方法
本試験の主な選択基準は、組織診または細胞診により診断されたmPDACである、前化学療法歴を有しない(術後補助化学療法最終投与から6ヶ月以上は適格とする)、RECISTv1.1で測定可能病変もしくは評価可能病変を有する、関連研究に利用可能な組織検体がある、ECOG PS 0もしくは1、十分な臓器機能を有することであった。また主な除外基準はPD-1、PD-L1、CTLA-4 を阻害する薬剤による前治療歴がある、原発性免疫不全症、臓器毒性、重度の免疫関連毒性の既往がある、免疫抑制療法中または既往(プレドニゾン10mg/日以上)、症候性またはコントロール困難な脳転移を有することであった。
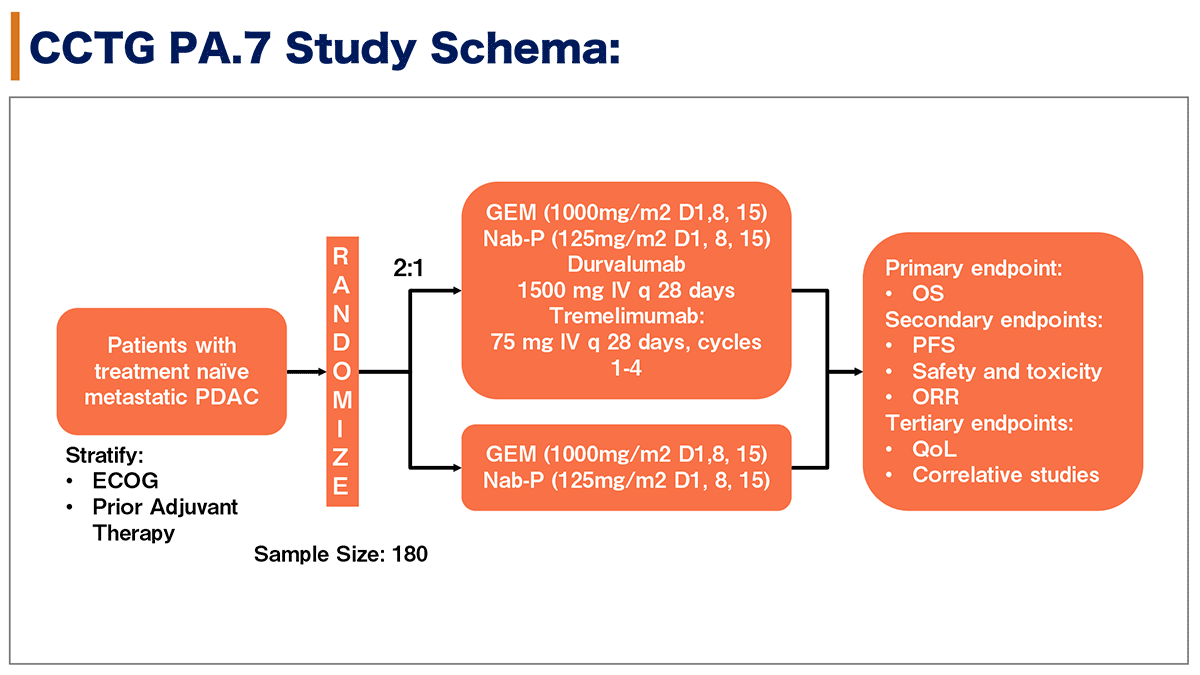
前治療歴のないmPDACの初回治療180例を対象に、GEM+Nab-P+D+T療法群とGEM+Nab-P療法群に、ECOG-PS、術後補助療法の有無を層別因子として、2:1にランダム化割付された。主要評価項目は全生存期間(OS)、副次評価項目は無増悪生存期間(P F S)、安全性、有害事象、客観的奏効率(ORR)であった。また、3次評価項目としてQoL、関連研究が挙げられた。(図1)
図1. 試験デザイン