Atezolizumab vs Platinum-Based Chemotherapy in Blood-Based Tumor mutational Burden-Positive NSCLC:Results of Blood Firset Assay Screening Trial (BFAST)Phase 3 Cohort C
First Author : Dziadziuszko R, et al.
血中TMB陽性非小細胞肺癌(NSCLC)におけるアテゾリズマブとプラチナ併用化学療法を比較した第3相コホート試験:Blood First Assay Screening Trial(BFAST)第3相コホートC結果
背景
Tumor mutational Burden(TMB)はNSCLCのみならず多くのがん種で免疫チェックポイント阻害薬(ICI)治療のバイオマーカーとしての有用性が示唆されているが、前向き第3相試験の報告はない。
Blood First Assay Screening Trial (BFAST)は血液検体を用いて次世代シークエンサーにより様々なドライバー遺伝子などが同定された進行再発NSCLC患者を対象にして分子標的治療やICIの安全性と有効性の評価を目的とした非盲検マルチコホート試験である。
BFASTコホートCは血液中のTMB(bTMB)がICIの効果予測因子になり得るかを検討するための前向き無作為化試験である。bTMB陽性で未治療進行再発NSCLC患者を対象としてアテゾリズマブとプラチナ併用療法を比較する初めての無作為化第3相試験である。
対象と方法
本試験はECOG-PS 良好、未治療の切除不能StageⅢB/ⅣかつEGFR/ALK遺伝子異常陰性のNSCLCでFoundation Medicine bTMB clinical trial assay (CTA)を用いてbTMBが陽性(cutoff bTMBスコアが10以上(9.1変異/Mb))であった患者を対象としアテゾリズマブ群(1200㎎,3週毎)とプラチナ併用療法群(4もしくは6サイクル,3週毎。非扁平上皮癌であればペメレトレキセド維持療法が許容される)に1対1で無作為割付されそれぞれ治療が実施された。層別化因子はECOG-PS, 組織型,組織提供の有無,bTMBスコア(中等度が10-15,高度が15以上)であった。
主要評価項目はbTMBが16以上(14.5変異/Mb)の患者におけるRECISTv1.1に基づく主治医判定による無増悪生存期間(PFS)であった。副次評価項目はITTにおけるbTMBが10以上の患者とbTMBが16以上の患者での全生存期間(OS),ITTでのRECISTv1.1に基づく主治医判定のPFS,主治医判定での奏効割合,奏効持続時間であった。評価項目は階層的に評価されるように設計された.
図1 試験デザイン
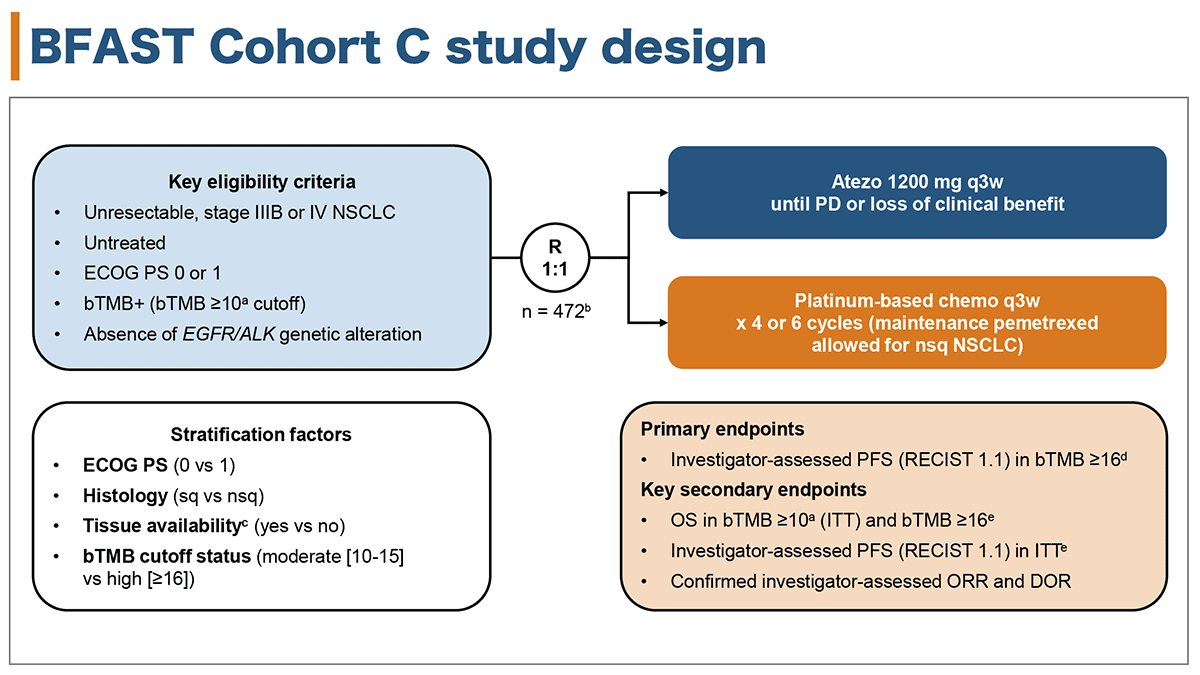
(発表者の許可を得て掲載)
