Multicenter Phase II trial of lenvatinib plus hepatic intra-arterial infusion chemotherapy with cisplatin for advanced hepatocellular carcinoma: LEOPARD
First Author : M. Ikeda, et al.
進行肝細胞癌に対するレンバチニブとシスプラチンによる肝動注化学療法の併用療法の多施設共同第2相試験
背景
切除不能肝細胞癌に対して、REFLECT試験の結果からレンバチニブ(LEN)はソラフェニブ(SOR)との非劣性が示されたことから、LENは一次治療の選択肢の一つとなっている1)。また、第2相試験において、SOR単剤療法と比較して、シスプラチン(CDDP)による肝動注化学療法(HAIC)とSORの併用療法が有効であったとの報告がある2)。一方で、第3相試験において、低用量(low-dose)CDDPと5-FUによる肝動注化学療法(HAIC)とSORの併用療法は、SOR単剤療法と比較して有意な生存期間の延長は示されなかった3)。したがって、現在、肝動注化学療法は切除不能肝細胞癌の治療の選択肢の一つであるが、標準治療としては位置づけられていない。本試験では、進行肝細胞癌に対して、レンバチニブ(LEN)とシスプラチン(CDDP)による肝動注化学療法の併用療法の有効性及び安全性を検討することを目的とした。
対象と方法
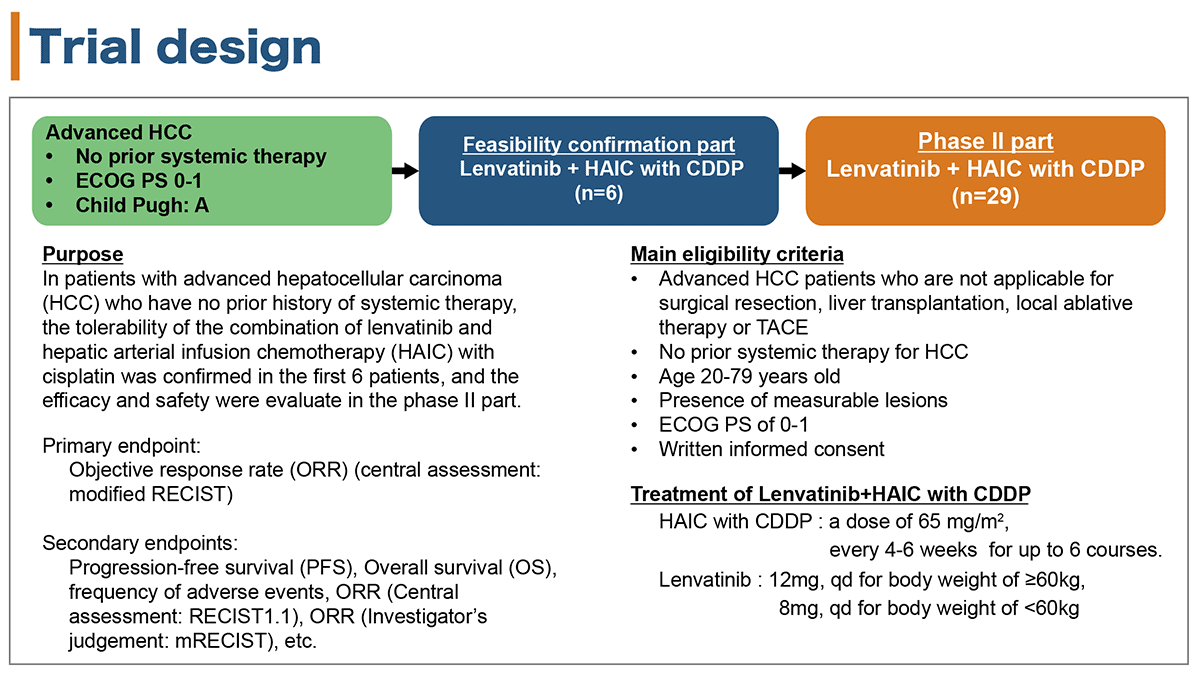
対象は、主な適格規準として、①外科的切除、肝移植、局所治療、肝動脈塞栓療法(TACE)が適応とならない、②Child-Pugh分類A、③全身薬物療法歴のない、進行肝細胞癌患者とした。
治療は、肝動脈動注療法はCDDP 65 mg/m2 を1回投与として、4-6週毎に最大6コース実施、レンバチニブは体重に応じて、60 kg以上であれば12 mg/m2 1日1回服用、60 kg未満であれば8 mg/m2 1日1回服用と設定した。
主要評価項目は、中央判定によるmodified RECIST(mRECIST)での客観的奏効割合(ORR)、副次評価項目は無増悪生存期間(PFS)、全生存期間(OS)、有害事象発現割合、中央判定によるRECISTでのORR、担当医判定によるmRECISTでのORRと設定した。対象患者数は、mRECISTによる閾値奏効割合を20 %、期待奏効割合を40 %、片側α= 0.05、検出力80 %と設定し、35人と予定した。
試験デザインは、まず忍容性評価パートとして、登録後最初の6人でLENとCDDPによるHAICの併用療法の忍容性を評価し、忍容性に問題がないと確認された後に、引き続いて残りの第2相試験パートの症例登録が可能となるようにデザインした。(図1)
図1 試験デザイン