Nal-IRI with 5-fluorouracil (5-FU) and leucovorin or gemcitabine plus cisplatin in advanced biliary tract cancer – final results of the NIFE-trial (AIO-YMO HEP-0315) - a randomized phase II study of the AIO biliary tract cancer group
First Author : Lukas Perkhofer
進行胆道癌一次治療におけるnal-IRI+5-FU/LV療法又はゲムシタビン+シスプラチン療法のランダム化第2相試験の最終結果(NIFE試験、AIO-YMO HEP-0315)
背景
進行胆道癌の一次治療の標準治療は、国内においてはKHBO1401 MITSUBA試験1)の結果からゲムシタビン+シスプラチン+S-1(GCS)療法であるが、海外においてはABC-02試験2)の結果から依然ゲムシタビン+シスプラチン(GC)療法が最も推奨されるレジメンである。一方、進行膵癌の二次治療において、新規DDS(Drug Delivery System)製剤であるイリノテカン内包リポソーム(nanoliposomal irinotecan、nal-IRI)が、5-FUとロイコボリン(LV)との併用療法として新たな標準治療となった3)。このnal-IRI+5-FU/LV療法は、進行胆道癌の二次治療においても、ランダム化比較第2相試験(NIFTY試験)4)で5-FU/LV療法に対して無増悪生存期間(PFS)および全生存期間(OS)を有意に延長することがASCO2021で報告され、胆道癌領域においても有効性が期待されている。本試験は、進行胆道癌の一次治療ラインにおけるnal-IRI+5-FU/LV療法の有効性を検討することを目的としたランダム化非比較第2相試験である。
対象と方法
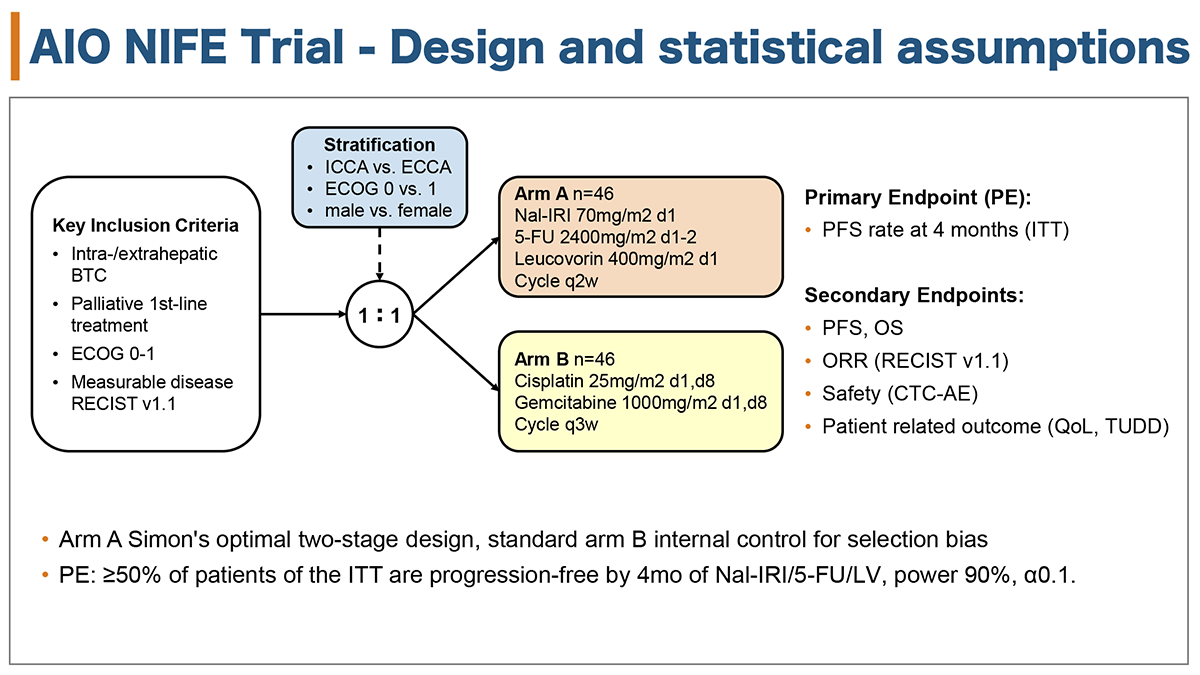
対象は、一次治療としての全身化学療法歴を有さない、ECOG PS 0-1、RECIST v1.1で測定可能病変を有する、18歳以上の切除不能な局所進行、もしくは遠隔転移を有する進行・再発胆道癌患者(乳頭部癌および胆嚢癌は除く)であった。治療方法は、試験治療群はnal-IRI+5-FU/LV療法[nal-IRI 70 mg/m2 (Day1), 5-FU 2400 mg/m2 (Day1-2), LV 400 mg/m2 (Day1), 2週毎]を行い、標準治療群はGC療法[ゲムシタビン 1000 mg/m2 (Day1,8), シスプラチン 25 mg/m2 (Day1,8), 3週毎]を行った(図1)。
主要評価項目は、4ヶ月時点の無増悪生存(PFS)割合であり、副次評価項目はPFS、全生存期間(OS)、奏効割合、安全性、患者報告アウトカム(QOL、TUDD)であった。本試験は1:1に割付けするランダム化第2相試験であったが、標準治療であるGC療法群は選択バイアスを考慮した内部コントロール群として設定されており、non-comparative studyとして両群間の統計学的な比較は行わないことが事前に規定されていた。統計学的デザインは単群第2相試験で用いられるSimon’s optimal two-stage designが用いられ、nal-IRI+5-FU/LV療法群の4ヶ月PFS割合の閾値を40%、期待値を60%として、片側α=0.1、検出力=0.9で算出され、必要症例数は46例に設定された。2段階の評価方法としては、最初の18例の登録症例のうち4ヶ月時点の無増悪生存が7例以下であった場合には試験を無効中止するstopping ruleを設け、試験継続の場合は計46例のうち23例以上に4ヶ月時点の無増悪生存が得られれば(4ヶ月PFS割合50%以上)、閾値以下であるという帰無仮説が棄却され統計的には有効性が期待できるという設定であった。
図1 試験デザイン