Unicancer PRODIGE 24/CCTG PA6 trial: Updated results of a multicenter international randomized phase 3 trial of adjuvant mFOLFIRINOX (mFFX) versus gemcitabine (gem) in patients (pts) with resected pancreatic ductal adenocarcinomas (PDAC).
First Author : Thierry Conroy et al.
膵癌術後補助化学療法におけるmodified FOLFIRINOX(mFFX)療法とゲムシタビン療法を比較した多施設共同ランダム化第3相試験(PRODIGE 24/CCTG PA6試験)のアップデート解析結果
背景
切除可能膵癌に対する術後補助化学療法において、modified FOLFIRINOX(mFFX)療法が、ゲムシタビン療法に対して無病生存期間(DFS)、全生存期間(OS)を有意に延長することがPRODIGE 24/CCTG PA6試験の結果から示され1)、海外においてはmFFX療法が標準治療レジメンの1つとして確立している。このPRODIGE 24/CCTG PA6試験は、早期有効中止の勧告がなされたため314例のイベントが観察された時点で(フォローアップ期間中央値33.6ヶ月)、結果が公表された。そのため、フォローアップ期間が短く61%の患者が生存しており、データが未熟な状態であった。本発表は、PRODIGE 24/CCTG PA6試験のOS予後因子解析も含めた5年のアップデート結果の報告である。
対象と方法
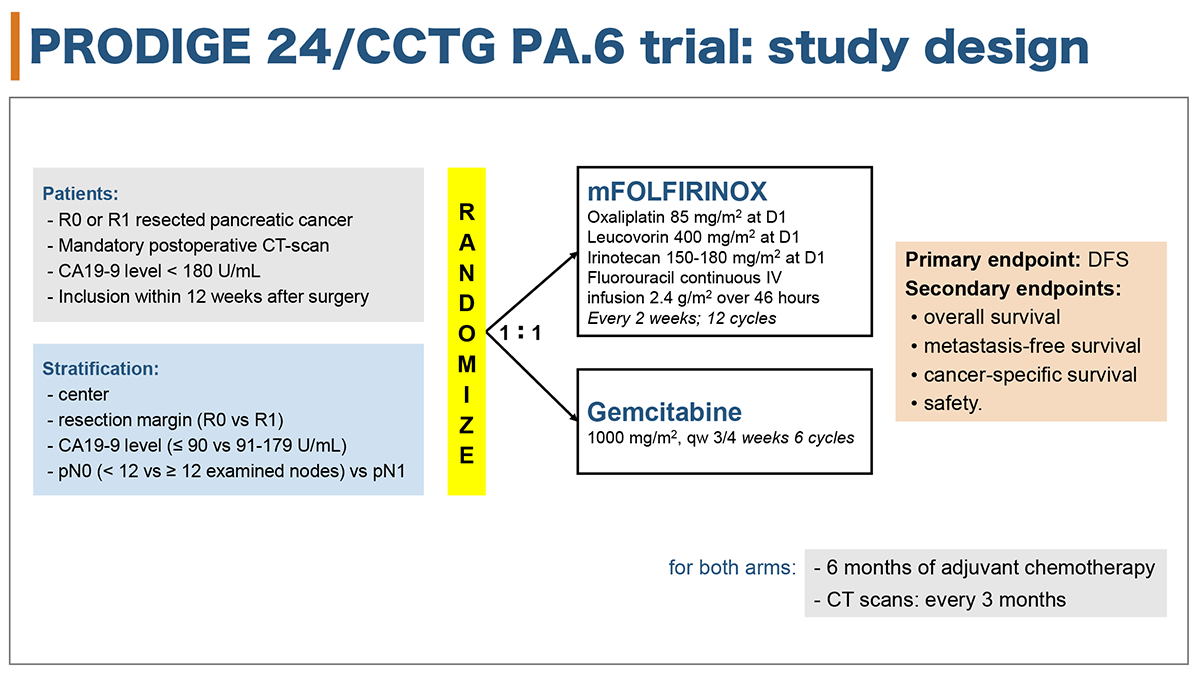
対象は、組織学的に膵管腺癌と診断され、R0/R1切除後12週以内、ECOG PS 0/1、術後CA19-9値 180 U/ml未満、臓器機能が保持されている18-79歳の膵癌術後の患者であった。方法は、層別化因子[施設、pN0/pN1、切除マージン(R0/R1)、術後CA19-9値(≦90/>90 U/mL)]により、mFFX群とゲムシタビン群に1:1に割付けされた。試験治療群はmFFX療法[オキサリプラチン 85 mg/m2 (Day1), イリノテカン 150-180 mg/m2(下痢の有害事象のため31症例目以降は150mg/m2に減量)(Day1), 5-FU 2400 mg/m2 (Day1-46h), ロイコボリン 400 mg/m2 (Day1), 2週毎, 計12コース]を行い、標準治療群はゲムシタビン療法[ゲムシタビン 1000 mg/m2 (Day1,8,15), 4週毎, 計6コース]を行った(図1)。
主要評価項目はDFSであり、副次評価項目はOS、無転移生存期間[metastasis-free survival(MFS)]、癌特異的生存期間[cancer-specific survival(SS)]、安全性であった。試験は、mFFX群の3年DFSがゲムシタビン群よりも10%高くなることを期待し(ハザード比0.74に相当)、両側α=0.05、検出力80%で計画され、必要イベント数342例、必要登録数490例として実施された。
図1 試験デザイン