Results from a global Phase 2 study of tislelizumab, an investigational PD-1 antibody, in patients with previously treated advanced hepatocellular carcinoma
First Author : Michel Ducreux, et al.
前治療歴がある進行肝細胞癌の患者に対する、抗PD-1抗体tislelizumabの国際共同第2相試験
背景
Tislelizumabは、PD-1に対して高い親和性と特異性を持つ抗PD-1モノクローナル抗体であり、マクロファージ上のFcγRへの結合を抑えることで、抗体依存性マクロファージを介したTエフェクター細胞のクリアランスを回避し、PD-1抗体の抗腫瘍活性を損なわないように設計されている1)。
Tislelizumabは肝細胞癌を含む進行性固形癌の患者に対して、良好な忍容性が確認され、抗腫瘍効果も報告されている2),3)。
今回、全身薬物療法の治療歴を有する進行肝細胞癌患者における、Tislelizumab のsingle armの第2相試験(RATIONALE 208試験)の結果を報告する。
対象と方法
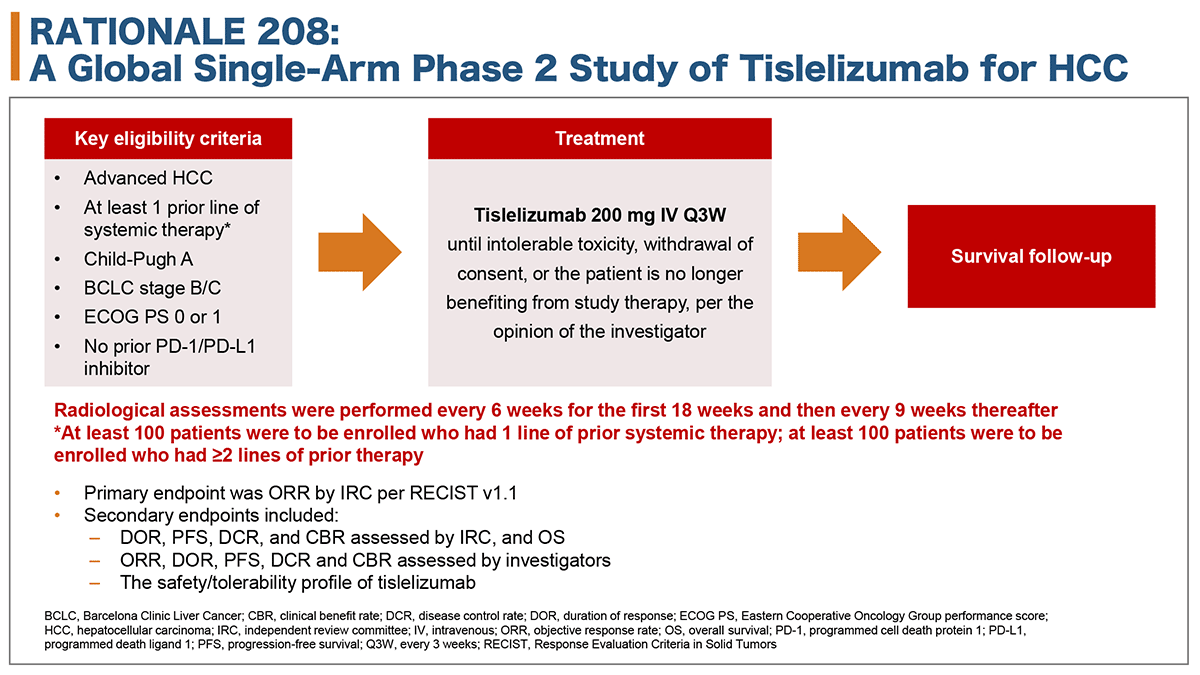
主な適格基準は、少なくとも1レジメン以上の全身薬物療法歴 (抗PD1抗体/抗PD-L1抗体は除く)のある進行肝細胞癌、Child-Pugh分類A、Barcelona Clinic Liver Cancer (BCLC) staging B/C、ECOG PS(Eastern Cooperative Oncology Group performance status)0/1、だった。
登録患者にTislelizumab 200mgを経静脈投与し、3週間を1サイクルとして、腫瘍増悪もしくは毒性中止と判断されるまで継続した。
主要評価項目は、独立効果判定委員会による客観的奏効割合(objective response rate : ORR)、副次評価項目は、奏効期間(duration of response : DOR)、無増悪生存期間(progression-free survival : PFS)、病勢制御割合(disease control rate : DCR)、臨床的有効割合(clinical benefit rate : CBR)、および安全性だった(図1)。
図1 試験デザイン