| 対象副作用 | 年, 月; 号: p-p. | 研究方法 (相) | 対象患者 | 対象薬剤 |
|---|---|---|---|---|
| 皮膚毒性 | 2015 11: 58–66. | ランダム化非盲検比較試験 | KRAS野生型mCRC | 皮膚保湿剤 |
背景
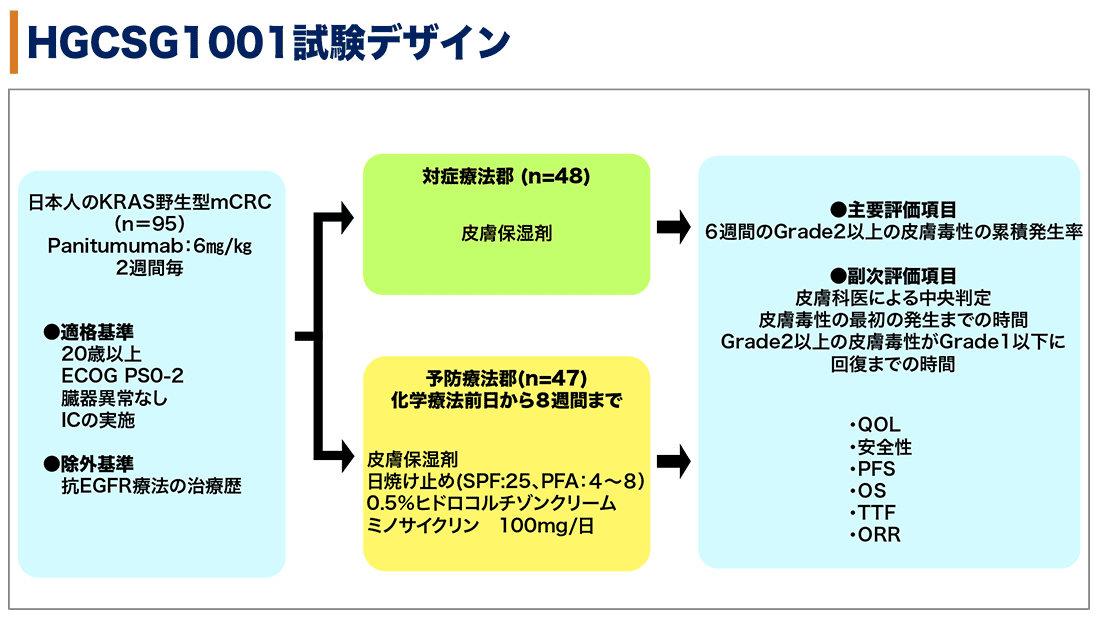
シェーマ
統計学的事項
主要評価項目
試験開始6週間の主治医評価でのGrade2以上の皮膚毒性の累積発生率
副次評価項目
皮膚科医による皮膚毒性の中央判定
各Gradeの皮膚毒性の発生までの時間、Grade2以上の皮膚毒性が発生した場合のGrade1以下に回復に要する時間
QOL
安全性
PFS:progression‐free survival (病勢進行または死亡までの時間)
OS:overall survival(死亡または最後のフォロ‐アップまでの日付)
TTF:time to treatment failure(死亡または治療の中止までの時間)
ORR:overall response rate(全生存率)
試験結果
対症療法群は保湿剤のみ(患者希望時は日焼け止め)、予防療法群はPanitumumabを含む治療投与前日から8週間、保湿剤と日焼け止め(SPF:25、PFA:4~8)、0.5%ヒドロコルチゾンクリ‐ムを1日2回局所に塗布、ミノサイクリン100㎎/日を1日1回内服した。
主要評価項目である試験開始6週間のGrade2以上の皮膚毒性の累積発生率は、対症療法群62.5%、予防療法群21.3%( 95%CI:9.6–33.0%)、(リスク比(RR):0.34; 95%CI:0.19–0.62;p<0.001)であり、予防療法群で有意に優れた有効性を示した。また、副次評価項目である皮膚科医による中央判定でも同様の傾向が示され、対症療法群50.0%、予防療法群18.6%(リスク比(RR):0.37;95%CI:0.19–0.74;p=0.002)となっていた。試験開始6週間で主治医評価と皮膚科医によって評価された皮膚毒性の累積毒性発生率の一致率は75.9%だった。
各皮膚障害の発生率
| 対症療法群(n=48※)、n(%) | 予防療法群(n=46※)、n(%) | |||||
|---|---|---|---|---|---|---|
| 全Grade | Grade 2 | ≧Grade 3 | 全Grade | Grade 2 | ≧Grade 3 | |
| 皮膚障害 | 41(85.4) | 24(58.5) | 14(29.2) | 40(87.0) | 16(34.8) | 9(19.6) |
| ざ瘡様皮疹 | 39(81.3) | 22(45.8) | 11(22.9) | 35(76.1) | 9(19.6) | 3(6.5) |
| 掻痒感 | 21(43.8) | 12(25.0) | 1(2.1) | 26(56.5) | 7(15.2) | 0 |
| 爪囲炎 | 22(45.8) | 15(31.3) | 2(4.2) | 17(37.0) | 6(13.0) | 3(6.5) |
※安全性集団は少なくとも1回のPanitumumab投与を受けた94人の患者。
一方、実臨床ではミノサイクリンの副作用として、吐き気や腹痛などの消化器症状や光線過敏症、めまいなどを経験することがある。休薬により回復することが多いが、消化器症状は化学療法自体の副作用との鑑別が難しい。また、光線過敏症はPmabの皮膚障害悪化の可能性もあるため、UVケアが重要である。
その他の副次評価項目について、Grade2以上の皮膚毒性が最初に発生するまでの時間の中央値は、予防療法群では到達せず、対症療法群では5.4週間(HR:0.50;95%CI:0.27–0.92;p=0.020)だった。PFSの中央値は予防療法群で3.6ヵ月、対症療法群で4.0ヵ月(HR=1.20, 95%CI:0.78‐1.84, p=0.413)で、TTF中央値は予防療法群で3.0ヵ月、対症療法群で3.5ヵ月(HR=1.23, 95%CI:0.80‐1.89,p=0.343)と両群間で有意な差はなかった。OS、ORRに統計的に有意な差はなかった。また12週間の観察期間における重度の皮膚毒性の発生率は、予防療法群の方が対症療法群よりも少なく、予防療法が初期段階だけでなく、それ以降にも有効であったことを示した。また、予防療法がPanitumumabの抗腫瘍効果に影響を与えないことも示した。
結語
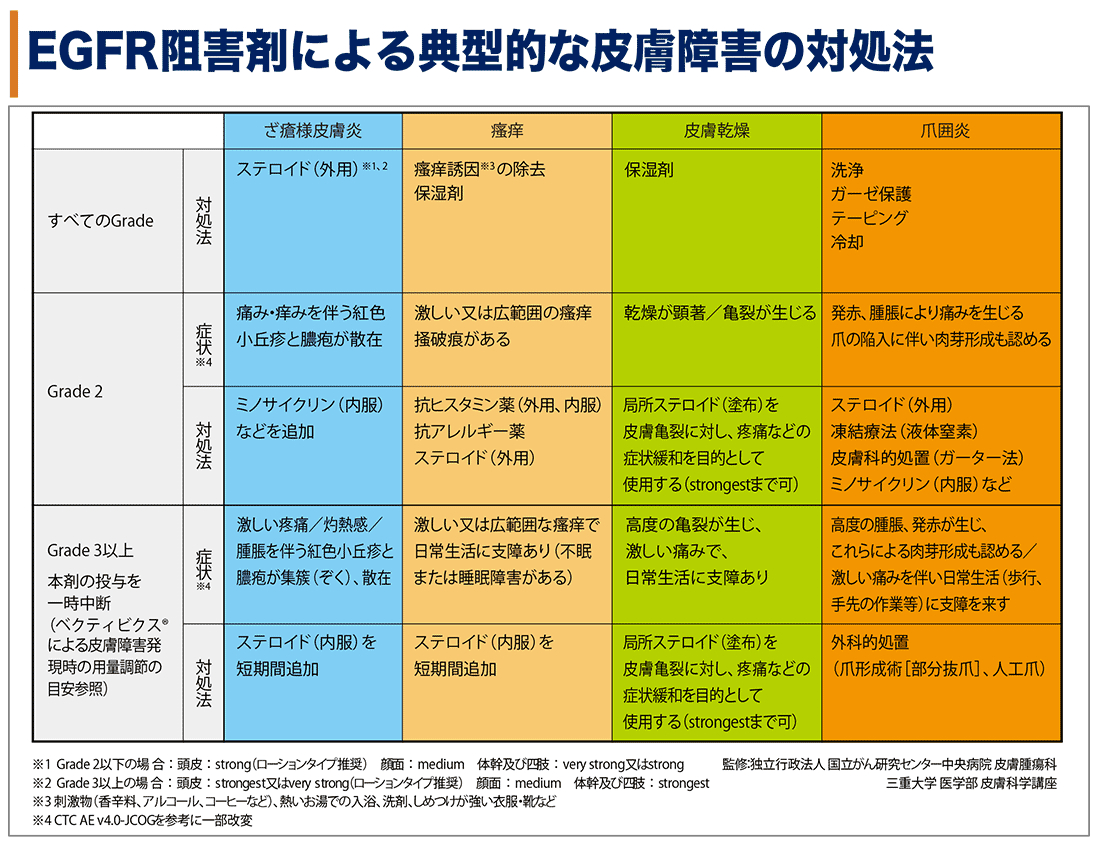
皮膚障害
(参照:ベクティビックス適正使用ガイド)