| 対象副作用 | 年, 月; 号: p-p. | 研究方法 (相) | 対象患者 | 対象薬剤 |
|---|---|---|---|---|
| 悪心・嘔吐 | 2018; 23: 382-388. | 第2相試験 | シスプラチン(≧50mg/m2)を含むHEC施行患者 | オランザピン |
背景
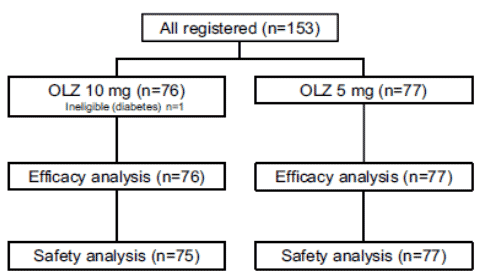
シェーマ
統計学的事項
主要評価項目:
遅発期(シスプラチン投与開始から24~120時間)のCR割合:complete response 嘔吐完全抑制割合(嘔吐なし、追加の制吐薬服用なしの割合)閉手順を適用してヒストリカルコントロール(TRIPLE試験のPAL群における遅発期のCR割合)に対する優越性の確認を実施。
副次評価項目:
- 急性期(シスプラチン投与開始0~24時間)、全期間(シスプラチン投与開始0~120時間)のCR割合:
- CC割合:complete control(嘔吐なし、追加の制吐薬なし、悪心軽度または無しの割合)
- TC割合 : total control(嘔吐なし、追加制吐薬なし、悪心なしの割合)
- TTF:time to first emetic episode or use of rescue medication(最初の催吐エピソードまたは追加の制吐薬使用までの時間)
試験結果
主な有害事象は傾眠であり、OLZ 10mg群で 53.3%、OLZ 5mg群で 45.5%に認められ、5mgの方が傾眠の発現割合が低い傾向だった。その他便秘(10mg群:16%、5mg群:19.5%)、ALT増加(10mg群:12.2%、5mg群:10.4%)、吃逆(10mg群:8.0%、5mg群:3.9%)や高血糖(10mg群:4.1%、5mg群:5.2%)などが認められた。
結語
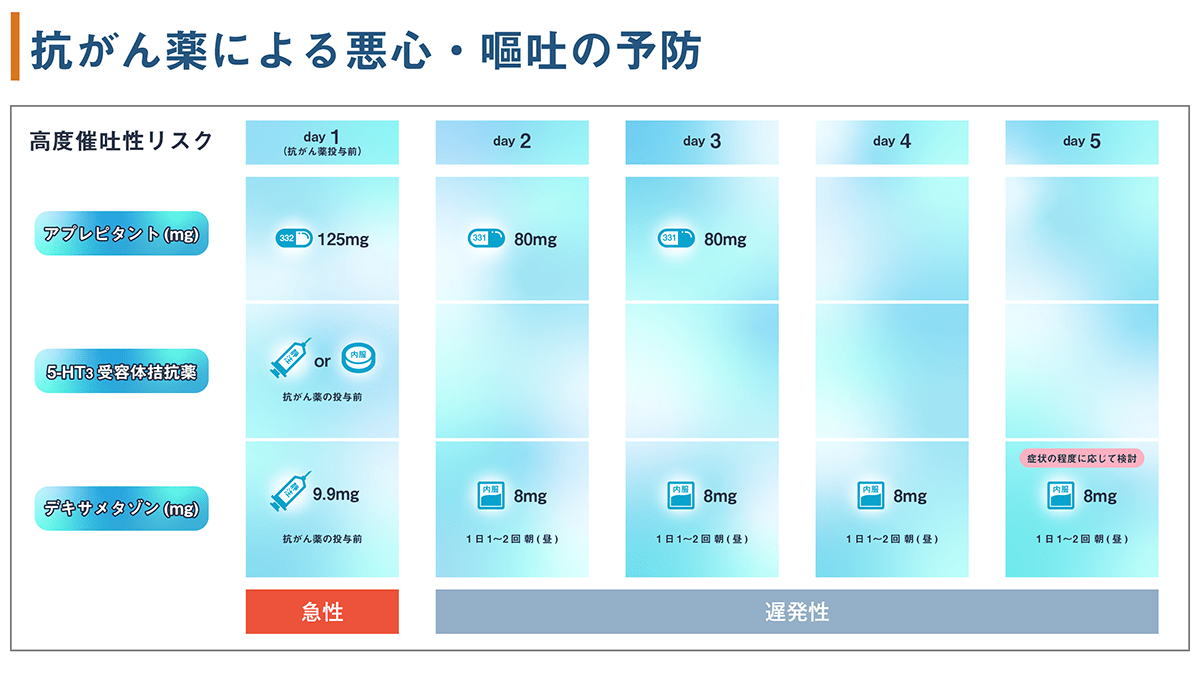
催吐性の高い化学療法(highly emetogenic chemotherapy:HEC)
| 高度(催吐性)リスク high emetic risk (催吐頻度 >90%) |
AC 療法: ドキソルビシン+シクロホスファミド、EC 療法: エピルビシン+シクロホスファミド、イホスファミド(≧ 2 g/m2/回)、エピルビシン(≧ 90 mg/m2)、シクロホスファミド(≧1,500 mg/m2)、シスプラチン、ストレプトゾシン、ダカルバジン、ドキソルビシン(≧ 60 mg/m2)、carmustine(>250 mg/m2)、mechlorethamine |
| 中等度(催吐性)リスク moderate emetic risk (催吐頻度 30~90%) |
カルボプラチン(HEC に準じた扱い)、アクチノマイシンD、アザシチジン、アムルビシン※2)、イダルビシン、イノツズマブ オゾガマイシン、イホスファミド(<2 g/m2/回)、イリノテカン、インターフェロン-α(≧10 million IU/m2)、インターロイキン-2(>12~15 million IU/m2)エノシタビン※2)、エピルビシン(<90 mg/m2)、オキサリプラチン、クロファラビン、三酸化ヒ素、シクロホスファミド(<1,500 mg/m3)、シタラビン(>200 mg/m2)、ダウノルビシン、テモゾロミド、ドキソルビシン(<60 mg/m2)、トラベクテジン、ネダプラチン※4)、ピラルビシン※5)、ブスルファン、ベンダムスチン、ミリプラチン6)、メトトレキサート(≧250 mg/m2)、メルファラン、aldesleukin(> 12-15 million IU/m2)、amifostine(>300 mg/m2)、carmustine(≦250 mg/m2)、dinutuximab |
| 軽度(催吐性)リスク low emetic risk (催吐頻度 10~30%) |
アテゾリズマブ、インターフェロン-α(5~10 million IU/m2)、インターロイキン-2(≦12 million IU/m2)、エトポシド、エリブリン、エロツズマブ、カバジタキセル、カルフィルゾミブ、ゲムシタビン、シタラビン(100~200 mg/m2)、ダラツムマブ、トラスツズマブ エムタンシン、ドキソルビシン リポソーム、ドセタキセル、ニムスチン※7)、ノギテカン、パクリタキセル、パクリタキセル アルブミン懸濁型、フルオロウラシル、ブレンツキシマブ、ペメトレキセド、ペントスタチン、マイトマイシンC、ミトキサントロン、メトトレキサート(50~250 mg/m2未満)、ラニムスチン※8)ロミデプシン、aldesleukin(≦ 12 million IU/m2)、amifostine(≦300 mg/m2)、belinostat、blinatumomab、floxuridine、irinotecan (lipospomal)、ixabepilone、necitumumab、omacetaxine、talimogene laherparepvec |
| 最小度(催吐性)リスク minimal emetic risk (催吐頻度 <10%) |
L-アスパラギナーゼ、アベルマブ、アフリベルセプト ベータ、アレムツズマブ、イピリムマブ、インターフェロン-α(≦5 million IU/m2)、オファツムマブ、クラドリビン、ゲムツズマブオゾガマイシン*、シタラビン(<100 mg/m2)、セツキシマブ、テムシロリムス、トラスツズマブ、ニボルマブ、ネララビン、パニツムマブ、ビノレルビン、ビンクリスチン、ビンデシン※9)、ビンブラスチン、プララトレキサート、フルダラビン、ブレオマイシン、ベバシズマブ、ペグインターフェロン、ペプロマイシン※10)、ペルツズマブ、ペンブロリズマブ、ボルテゾミブ、メトトレキサート(≦50 mg/m2)、ラムシルマブ、リツキシマブ、decitabine、denileukin diftitox、obinutuzumab、pegaspargase、pixantrone、siltuximab、valrubicin、vincristine(liposomal) |
3剤併用療法
悪心・嘔吐の対するオランザピンについて
Olanzapine (ジプレキサ®)
【公知とされた効能・効果等の概要】
抗悪性腫瘍剤(シスプラチン等)投与に伴う消化器症状(悪心、嘔吐)他の制吐剤との併用において、通常、成人にはオランザピンとして5mgを1日1回経口投与する。なお、患者の状態により適宜増量するが、1日量は10mgを超えないこと。
公知とされた効能・効果等の概要:
抗悪性腫瘍剤(シスプラチン等)投与に伴う消化器症状(悪心、嘔吐)
先行研究
Navari RM, Einhorn LH, Passik SD et al (2005) A phase II trial of olanzapine for the prevention of chemotherapy-induced nausea and vomiting: a Hoosier Oncology Group study. Support Care Cancer 13:529–534. doi:10.1007/s00520-004-0755-6
Navari RM, Einhorn LH, Loehrer PJ Sr et al (2007) A phase II trial of olanzapine, dexamethasone, and palonosetron for the prevention of chemotherapy-induced nausea and vomiting: a Hoosier oncology group study. Support Care Cancer 15:1285–1291. doi:10.1007/s00520-007-0248-5
Tan L, Liu J, Liu X et al (2009) Clinical research of Olanzapine for prevention of chemotherapy-induced nausea and vomiting. J Exp Clin Cancer Res 28:131. doi:10.1186/1756-9966-28-131
Navari RM, Gray SE, Kerr AC (2011) Olanzapine versus aprepitant for the prevention of chemotherapy-induced nausea and vomiting: a randomized phase III trial. J Support Oncol 9:188–195. doi:10.1016/j.suponc.2011.05.002
Navari RM, Nagy CK, Gray SE (2013) The use of olanzapine versus metoclopramide for the treatment of breakthrough chemotherapy-induced nausea and vomiting in patients receiving highly emetogenic chemotherapy. Support Care Cancer 21:1655–1663. doi:10.1007/s00520-012-1710-6