| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 肝細胞癌 | 一次治療 | 第3相 | 全生存期間 | 国際 | あり |
試験名 :HIMALAYA
レジメン:デュルバルマブ+トレメリムマブ vsデュルバルマブvs ソラフェニブ
登録期間:2017年10月〜2019年6月
背景
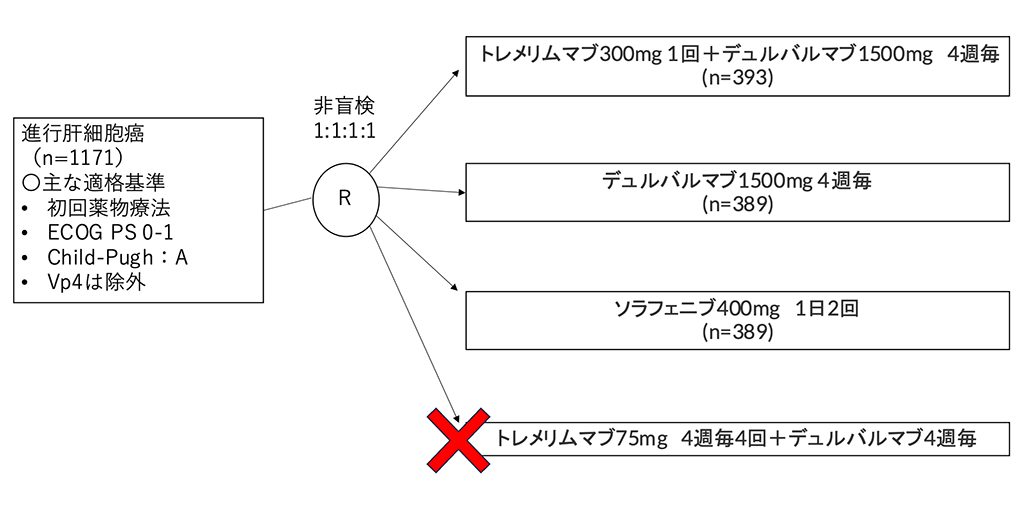
切除不能肝細胞癌に対する治療として、PD-1またはPD-L1阻害薬と様々なマルチキナーゼ阻害薬や血管内皮増殖因子(VEGF)阻害薬、細胞傷害性Tリンパ球関連抗原4(CTLA-4)阻害薬の組み合わせが期待されている。これらのうちアテゾリズマブ(PD-L1阻害薬)+ベバシズマブ(VEGF阻害薬)はソラフェニブ(Sora)と比較して全生存期間の改善を示し、現在、切除不能肝細胞癌の1次治療として使用されている。その他の組み合わせとして、腫瘍の免疫逃避機構を抑制し抗腫瘍免疫反応を誘発するPD-L1阻害薬とT細胞を活性化させ、がんに対する免疫反応を増強し、がん細胞死を引き起こすCTLA-4阻害薬を同時に用いることで相補的な免疫賦活作用を示すことが期待されており、PD-L1阻害薬であるデュルバルマブ(Durva)とCTLA-4阻害薬であるトレメリムマブ(Treme)を組み合わせたレジメンの有用性を検証する第3相試験(HIMALAYA)が実施された。HIMALAYAは、進行肝細胞癌の初回薬物療法症例を対象として、Treme 300mg 1回+Durva 1500mg 4週毎(STRIDE群)、Durva 1500mg 4週毎(Durva群)、Sora 400mg 1日2回(Sora群)、Treme 75mg 4週毎4回+Durva 4週毎(T75+D群)の4群を比較する第3相試験としてはじまったが、試験中に第2相試験であるStudy22の結果で、T75+Dレジメンが安全性では許容できるものの、Durva単剤と比べて有効性の点で有意差を認めないことが示されたため、T75+D群は中止となり、3群の比較試験となった。
シェーマ
統計学的事項
主要評価項目:全生存期間
主要評価項目は全生存期間で、STRIDE群はSora群に対する優越性の検証、Durva群はSora群に対する非劣性の検証である。副次評価項目は、無増悪生存期間、客観的奏効割合、奏効期間、患者報告アウトカム、安全性などであった。有効性の解析はIntent-to-treat 解析で行われた。最終解析は、STRIDE群の優越性の検証で515人の死亡のイベントがある場合に検出力は97%、ハザード比が0.70を設定した。Durvaの非劣性の検証は560人の死亡のイベントがある場合に検出力は84%で、非劣性マージンを1.08未満と設定した。解析はCox比例ハザードモデルで、Log-rank検定で行われた。試験結果:
- 2017年10月から2019年6月にかけて、16カ国の181施設で1950例の患者をスクリーニングし、1171例の患者が登録され、393例がSTRIDE群に、389例がDurva群に、389例がSora群に割り付けられた。
- 患者背景に大きな差は認められなかった。
1. 全生存期間(主要評価項目)
- STRIDE群はSora群に対して全生存期間を統計学的に有意に改善することが示された。
- Durva群はSora群に対して全生存期間が統計学的に非劣性であることが示された。
| レジメン | イベント, no. (%) | 中央値(95%信頼区間(CI)) | Hazard Ratio(HR)(95%CI) |
| STRIDE群 (n=393) | 262(66.7%) | 16.43か月(14.16-19.58) | 0.78(0.65-0.93) |
| Durva群(n=389) | 280(72.0%) | 16.56か月(14.06-19.12) | 0.86(0.73-1.03) |
| Sora群(n=389) | 293(75.3%) | 13.77か月(12.25-16.13) | - |
2. 無増悪生存期間
- 無増悪生存期間については、STRIDE群、Durva群ともにSora群に対して統計学的な有意差は示されなかった。
| レジメン | イベント, no. (%) | 中央値(95%CI) | HR(95%CI) |
| STRIDE群 (n=393) | 335(85.2%) | 3.78か月(3.68-5.32) | 0.90(0.77-1.05) |
| Durva群(n=389) | 345(88.7%) | 3.65か月(3.19-3.75) | 1.02(0.88-1.19) |
| Sora群(n=389) | 327(84.1%) | 4.07か月(3.75-5.49) | - |
3. 奏効割合 (RESIST1.1、担当医判定)
- STRIDE群、Durva群ではCR症例がみられたが、Sora群ではみられなかった。
- 奏効割合は、Sora群に比べて、STRIDE群やDurva群で良好な傾向がみられたが、STRIDE群とDurva群の間に明らかな差はみられなかった。
| レジメン | 奏効割合(RESIST1.1) | 95%CI |
| STRIDE群 (n=393) | 20.1% (CR12例、PR67例) | 1.84-3.98 |
| Durva群(n=389) | 17.0% (CR6例、PR60例) | 1.87-3.98 |
| Sora群(n=389) | 5.1% (CR0例、PR20例) | 1.89-8.44 |
4. QOL・身体機能・役割機能低下までの期間(EORTC QLQ-C30)
- Sora群に比べてSTRIDE群やDurva群では有意にQOL・身体機能・役割機能低下までの期間の延長がみられた。
- STRIDE群とDurva群の間に明らかな差はみられなかった。
| レジメン | イベント, no. (%) | 中央値(95%CI) | HR(95%CI) |
| STRIDE群(n=302) | 142(47.0%) | 7.5か月(5.82-10.84) | 0.76(0.61-0.96) |
| Durva群(n=319) | 153(48.0) | 7.4か月(5.68-9.33) | 0.77(0.62-0.96) |
| Sora群(n=323) | 162(50.2) | 5.7か月(4.80-7.39) | - |
5. 有害事象(NCI CTCAE ver.4.0)
〇それぞれの治療群でのすべての有害事象と免疫関連有害事象
- Durva群と比較してSTRIDE群でより多くの免疫関連有害事象がみられた。
- STRIDE群ではステロイド治療を有する有害事象が20.1%とやや高頻度にみられた。
| n, (%) | STRIDE(n=388) | Durva(n=388) | Sorafenib(n=374) |
| すべての有害事象 | |||
| Any grade | 378 (97.4) | 345 (88.9) | 357 (95.5) |
| Grade3 or 4 | 196 (50.5) | 144 (37.1) | 196 (52.4) |
| 免疫関連有害事象 | |||
| Any grade | 139 (35.8) | 64 (16.5) | - |
| Grade3 or 4 | 49 (12.6) | 25 (6.4) | - |
| ステロイドを使用した症例 | 78 (20.1) | 37 (9.5) | - |
〇それぞれの治療群での有害事象の割合
- VEGF阻害薬が使用されていないため、消化管出血や食道静脈瘤出血の有害事象はみられなかった。
- STRIDE群、Durva群ともに下痢の有害事象が高頻度にみられた。
| STRIDE群(n=388) | Durva群(n=388) | Sora群(n=374) | ||||
|---|---|---|---|---|---|---|
| Any Grade, no. (%) |
Grade 3 or 4, no. (%) |
Any Grade, no. (%) |
Grade 3 or 4, no. (%) |
Any Grade, no. (%) |
Grade 3 or 4, no. (%) |
|
| 下痢 | 103 (26.5) | 17 (4.4) | 58 (14.9) | 6 (1.5) | 167 (44.7) | 16 (4.3) |
| 便秘 | 36 (9.3) | 0 | 42(10.8) | 0 | 35(9.4) | 0 |
| 腹痛 | 46 (11.9) | 5 (1.3) | 37 (9.5) | 4 (1.0) | 63 (16.8) | 12 (3.2) |
| 吐き気 | 47 (12.1) | 0 | 37 (9.5) | 0 | 53 (14.2) | 0 |
| 掻痒感 | 89 (22.9) | 0 | 56 (14.4) | 0 | 24 (6.4) | 1 (0.3) |
| 発疹 | 87 (22.4) | 6 (1.5) | 40 (10.3) | 1 (0.3) | 51 (13.6) | 4 (1.1) |
| 脱毛 | 2 (0.5) | 0 | 5 (1.3) | 0 | 53 (14.2) | 0 |
| 手足症候群 | 3 (0.8) | 0 | 1 (0.3) | 0 | 174 (46.5) | 34(9.1) |
| AST上昇 | 48 (12.4) | 20 (5.2) | 56 (14.4) | 26 (6.7) | 24(6.4) | 12(3.2) |
| ALT上昇 | 36 (9.3) | 10 (2.6) | 44 (11.3) | 12 (3.1) | 20(5.3) | 7(1.9) |
| アミラーゼ上昇 | 29 (7.5) | 14 (3.6) | 9 (2.3) | 3 (0.8) | 10 (2.7) | 4 (1.1) |
| ビリルビン上昇 | 20 (5.2) | 3 (0.8) | 23 (5.9) | 7 (1.8) | 29 (7.8) | 8 (2.1) |
| γGTP上昇 | 18 (4.6) | 8 (2.1) | 12 (3.1) | 7 (1.8) | 19(5.1) | 7(1.9) |
| リパーゼ上昇 | 34 (8.8) | 24 (6.2) | 23 (5.9) | 16 (4.1) | 15 (4.0) | 11 (2.9) |
| 食欲不振 | 66 (17.0) | 5 (1.3) | 53 (13.7) | 2 (0.5) | 67 (17.9) | 3 (0.8) |
| 無力症 | 39 (10.1) | 7 (1.8) | 49 (12.6) | 8 (2.1) | 44 (11.8) | 10 (2.7) |
| 疲労 | 66 (17.0) | 8 (2.1) | 38 (9.8) | 0 | 71(19.0) | 11 (2.9) |
| 発熱 | 50 (12.9) | 1 (0.3) | 36 (9.3) | 7 (1.8) | 33(8.8) | 0 |
| 末梢性浮腫 | 33 (8.5) | 2 (0.5) | 24 (6.2) | 1 (0.3) | 19(5.1) | 0 |
| 咳嗽 | 30 (7.7) | 0 | 31(8.0) | 0 | 22(5.9) | 1 (0.3) |
| 不眠症 | 40 (10.3) | 1 (0.3) | 21 (5.4) | 0 | 16(4.3) | 0 |
| 甲状腺機能低下症 | 47 (12.1) | 0 | 19(4.9) | 0 | 16(4.3) | 0 |
| 高血圧症 | 23 (5.9) | 7 (1.8) | 17 (4.4) | 4 (1.0) | 68 (18.2) | 23 (6.1) |
| 貧血 | 36 (9.3) | 11 (2.8) | 29 (7.5) | 9 (2.3) | 33 (8.8) | 12 (3.2) |
| 高カリウム血症 | 20 (5.2) | 6 (1.5) | 20 (5.2) | 8 (2.1) | 13 (3.5) | 9 (2.4) |
| 低カリウム血症 | 13 (3.4) | 4 (1.0) | 9 (2.3) | 3 (0.8) | 12 (3.2) | 2 (0.5) |
| 低ナトリウム血症 | 21 (5.4) | 16 (4.1) | 12 (3.1) | 5 (1.3) | 15 (4.0) | 11 (2.9) |
結語
切除不能肝細胞癌に対する一次治療として、STRIDE群はSora群に比較して、全生存期間を有意に延長した。Durva群は、全生存期間においてSora群に対して非劣性を示した。STRIDE群、Durva群はともに良好な安全性プロファイルを示した。
現在、日本の肝癌診療ガイドライン2021年度版(2023年5月30日改訂版)では、切除不能肝細胞癌に対する一次治療として、アテゾリズマブ+ベバシズマブ併用療法とSTRIDEレジメンはどちらも選択が可能と記載されており、これらのレジメンの使い分けやこれらの治療に不応/不耐な症例での最適な2次治療については、今後、検討が必要である。
現在、日本の肝癌診療ガイドライン2021年度版(2023年5月30日改訂版)では、切除不能肝細胞癌に対する一次治療として、アテゾリズマブ+ベバシズマブ併用療法とSTRIDEレジメンはどちらも選択が可能と記載されており、これらのレジメンの使い分けやこれらの治療に不応/不耐な症例での最適な2次治療については、今後、検討が必要である。
執筆:国立がん研究センター東病院 肝胆膵内科 平 知尚 先
監修:国立がん研究センター東病院 肝胆膵内科 科長 池田 公史 先生
監修:国立がん研究センター東病院 肝胆膵内科 科長 池田 公史 先生