| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 肝細胞癌 | 術後補助療法 | 第3相 | 無再発生存期間 | 国際 | あり |
試験名 :IMbrave050
レジメン:アテゾリズマブ+ベバシズマブ vs Active surveillance
登録期間:2019年12月31日~2021年11月25日
背景
現在、肝細胞癌に対する術後補助療法としての標準治療は確立していない。肝細胞癌の術後5年再発率は70%を超えると報告され、特に再発高リスク群(腫瘍径が大きい、多発、低分化、脈管侵襲など)ではさらに再発リスクは高い。再発時期の特徴としては、術後1-2年の早期再発と4-5年の晩期再発の二峰性のパターンを呈する。
切除不能肝細胞癌を対象として抗PD-L1抗体であるアテゾリズマブと抗VEGF抗体であるベバシズマブの併用療法をソラフェニブと比較した第Ⅲ相試験(IMbrave150試験)で、アテゾリズマブ+ベバシズマブ併用療法は全生存期間、無増悪生存期間において優越性を示し、切除不能肝細胞癌に対する標準的な一次薬物療法となった。そこで今回、根治治療後の再発リスクの高い肝細胞癌に対する術後補助療法として、アテゾリズマブ+ベバシズマブ併用療法とActive surveillanceを比較した非盲検無作為化比較第3相試験が行われた。
切除不能肝細胞癌を対象として抗PD-L1抗体であるアテゾリズマブと抗VEGF抗体であるベバシズマブの併用療法をソラフェニブと比較した第Ⅲ相試験(IMbrave150試験)で、アテゾリズマブ+ベバシズマブ併用療法は全生存期間、無増悪生存期間において優越性を示し、切除不能肝細胞癌に対する標準的な一次薬物療法となった。そこで今回、根治治療後の再発リスクの高い肝細胞癌に対する術後補助療法として、アテゾリズマブ+ベバシズマブ併用療法とActive surveillanceを比較した非盲検無作為化比較第3相試験が行われた。
シェーマ
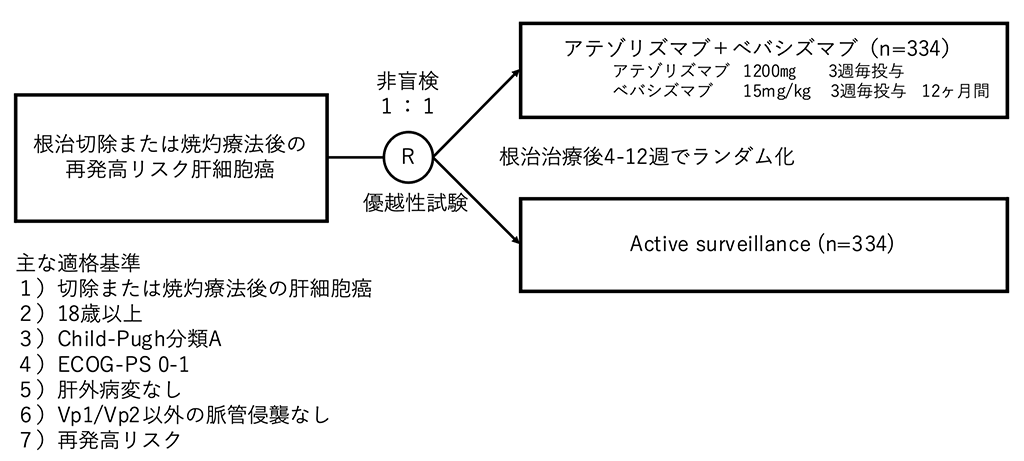
再発高リスクの定義は、切除では①腫瘍数が3個以下で最大腫瘍径3㎝超、②腫瘍数が4個以上で最大腫瘍径5㎝以下、③腫瘍数が3個以下で最大腫瘍径5㎝以下かつ、脈管侵襲ありもしくは低分化とされた。焼灼療法では①単発で2㎝超5㎝以下、②腫瘍数2-4個で5㎝以下とされた。
統計学的事項
主要評価項目:無再発生存期間
本試験の主要評価項目は中央判定の無再発生存期間(RFS)、副次評価項目は全生存期間、治験担当医判定のRFS、再発期間などとされた。Active surveillance群を対照としてアテゾリズマブ+ベバシズマブ(Atezo+Bev)群のRFSのハザード比が0.73となることを検証する優越性試験として設計され、検出力80%、両側 α=0.05としたところ、662例の登録、243イベントが必要と設定された。RFSの中間解析は、236のRFSイベント発生時に予定され、α=0.0195消費が設定された。主要評価項目で統計学的有意性を示した場合、主要副次評価項目の全生存期間の解析を実施することとされた。試験結果:
- 日本を含む26か国の134施設から668例が登録され、334例がAtezo+Bev群、334例がActive surveillance群に割り付けられた。地域、高リスク因子数、根治治療法、術後肝動脈化学塞栓療法(TACE)の有無で層別化された。
- 予定された中間解析のデータカットオフは2022年10月21日で、観察期間中央値は17.4ヶ月であった。
- 患者背景は、年齢中央値59歳、アジアが82%、B型肝炎が62%、BCLC Stage Aが84%、切除が88%であった。両群間で患者背景に大きな差は認めなかった。術後TACEは1回まで許容されており、10%がTACEを受けていた。
- Active surveillance群において、RFSイベント後のクロスオーバーは許容されており113例中81例(61%)がAtezo+Bev併用療法を受けた。
1. 無再発生存期間(主要評価項目、中央判定)
- 有効性評価はIntention-to-treat集団で行われた。
- Atezo+Bev群の33%、Active surveillance群40%でRFSイベントを認めた。
- 中央判定のRFS中央値は両群ともに未到達であったが、HR 0.72 (95% CI, 0.56-0.93, p=0.012)であり、Atezo+Bev群で28%のリスク低下を認めた。
- サブグループ解析においても、ほとんどのサブグループにおいてAtezo+Bev群が良好な結果であった。
| 中央値 | 95%信頼区間 | ||
| Atezo+Bev群 | 未到達 | 22.1-NE | HR 0.72 (95% CI, 0.56-0.93) p=0.012 |
| Active surveillance群 | 未到達 | 21.4-NE |
NE=could not be evaluated
2. 12ヶ月RFS無再発生存率(中央判定)
| 中央値 | 95%信頼区間 | |
| Atezo+Bev群 | 78% | 73-82 |
| Active surveillance群 | 65% | 60-71 |
3. 無再発生存期間(治験担当医師判定)
- 治験担当医師判定のRFS中央値は両群ともに未到達であったが、HR 0.70 (95% CI, 0.54-0.91, p=0.007)であり、Atezo+Bev群で有意なリスク低下を認めた。
| 中央値 | 95%信頼区間 | ||
| Atezo+Bev群 | 未到達 | 24.2-NE | HR 0.70 (95% CI, 0.54-0.91) p=0.007 |
| Active surveillance群 | 未到達 | 22.7-NE |
NE=could not be evaluated
4. 12ヶ月無再発生存率(治験担当医師判定)
| 中央値 | 95%信頼区間 | |
| Atezo+Bev群 | 79% | 74-83 |
| Active surveillance群 | 68% | 62-73 |
5. 12ヶ月再発率
- 12ヶ月再発率はAtezo+Bev群20%、Active surveillance群34%、HR 0.67 (95% CI, 0.52-0.88, p=0.003)であり、Atezo+Bev群で33%のリスク低下を認めた。
| 中央値 | 95%信頼区間 | ||
| Atezo+Bev群 | 20% | 16-24 | HR 0.67 (95%CI, 0.52-0.88) p=0.003 |
| Active surveillance群 | 34% | 29-40 |
6. 全生存期間
- RFS中間解析時のOSイベントは全体でわずか7%(Atezo+Bev群8%、Active surveillance群6%)であり、immatureな状況であった。
| 中央値 | 95%信頼区間 | ||
| Atezo+Bev群 | 未到達 | NE | R 1.42 (95% CI, 0.80-2.54) |
| Active surveillance群 | 未到達 | NE |
NE=could not be evaluated
7. 有害事象
- 安全性評価はAtezo+Bev群の332例、Active surveillance群330例で行われた。
- Atezo+Bev群の治療サイクル中央値は17サイクルで、治療期間中央値は11.1ヶ月であった。
- Grade 3/4の有害事象(AE)はAtezo+Bev群の41%、Active surveillance群の13%で認めた。両群間で2%以上の差があるGrade3/4のAEは蛋白尿、高血圧、血小板減少であった。
- Grade 5のAEをAtezo+Bev群で6例(2%;COVID-19 1例、誤嚥性肺炎1例、食道静脈瘤出血1例、上部消化管出血1例、脳梗塞1例)、Active surveillance群で1例(<1%;食道静脈瘤出血1例)に認めた。Atezo+Bev群の2例(食道静脈瘤出血、脳梗塞)は治療関連と判断された。
- 免疫関連の有害事象(immune-mediated AE: imAE)は、Atezo+Bev群の63%、Active surveillance群の18%で認めた。最も多いimAEは肝炎で、次いで甲状腺機能低下症であった。Grade 3/4のimAEはAtezo+Bev群の10%、Active surveillance群の2%に認め、全身ステロイド投与はAtezo+Bev群の8%、Active surveillance群の1%で行われた。
- Atezo+Bev群におけるAEによる治療中止は9%であった。
| Atezo+Bev群(n=332) | Active surveillance群(n=330) | |||||
|---|---|---|---|---|---|---|
| 全Grade | Grade 3/4 | Grade 5 | 全Grade | Grade 3/4 | Grade 5 | |
| 全AE | 326(98%) | 136(41%) | 6(2%) | 205(62%) | 44(13%) | 1(<1%) |
| 治療関連AE | 293(88%) | 116(35%) | 2(<1%) | NA | NA | NA |
| 蛋白尿 | 154(46%) | 29(9%) | 0 | 12(4%) | 0 | 0 |
| 高血圧 | 127(38%) | 61(18%) | 0 | 10(3%) | 3(1%) | 0 |
| 血小板減少 | 66(20%) | 15(5%) | 0 | 22(7%) | 4(1%) | 0 |
| AST上昇 | 52(16%) | 3(1%) | 0 | 18(5%) | 2(1%) | 0 |
| ALT上昇 | 47(14%) | 2(1%) | 0 | 18(5%) | 3(1%) | 0 |
| 甲状腺機能低下 | 47(14%) | 0 | 0 | 1(<1%) | 0 | 0 |
| 関節痛 | 40(12%) | 1(<1%) | 0 | 8(2%) | 1(<1%) | 0 |
| 皮膚掻痒症 | 40(12%) | 1(<1%) | 0 | 3(1%) | 0 | 0 |
| 皮疹 | 40(12%) | 0 | 0 | 1(<1%) | 0 | 0 |
| ビリルビン上昇 | 34(10%) | 1(<1%) | 0 | 23(7%) | 1(<1%) | 0 |
| 発熱 | 34(10.2%) | 0 | 0 | 7(2%) | 0 | 0 |
結語
根治治療後の再発リスクの高い肝細胞癌に対する術後補助療法として初めて、アテゾリズマブ+ベバシズマブ併用療法はActive surveillanceと比較して無再発生存期間を有意に延長した。ただし、全生存期間については現時点ではフォローアップ期間がimmatureなデータであり、今後長期のフォローアップデータをみる必要がある。また術後補助療法を行うべき患者集団をさらに選択していく必要がある。
執筆:国立がん研究センター東病院 肝胆膵内科 井上 佳苗 先生
監修:国立がん研究センター東病院 肝胆膵内科 池田 公史 先生
監修:国立がん研究センター東病院 肝胆膵内科 池田 公史 先生