| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胆道癌 | 一次治療 | 第3相 | 全生存期間 | 英国 | なし |
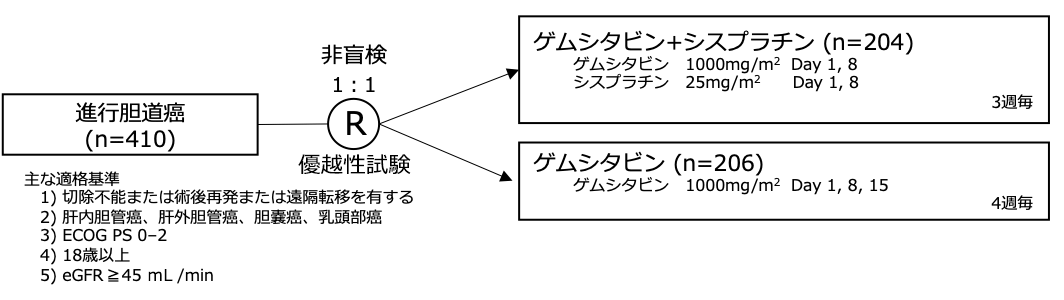
試験名 :ABC-02
レジメン:ゲムシタビン+シスプラチン vs ゲムシタビン
登録期間:2002年2月〜2008年10月
背景
進行胆道癌は化学療法が奏効する可能性があると考えられていたが、ランダム化試験は行われておらず、標準治療が確立していなかった。ゲムシタビンは膵癌への有効性が報告されて以降、胆道癌に対しても多く用いられるようになっており、シスプラチンは肺癌や膀胱癌などで、ゲムシタビンとの相加または相乗効果が報告されていた。
進行胆道癌に対するゲムシタビンとシスプラチン併用療法の第2相試験(ABC-01)において、無増悪生存期間の延長が示されたため、ゲムシタビン単剤とのランダム化第3相試験の実施へと移行した。
進行胆道癌に対するゲムシタビンとシスプラチン併用療法の第2相試験(ABC-01)において、無増悪生存期間の延長が示されたため、ゲムシタビン単剤とのランダム化第3相試験の実施へと移行した。
シェーマ
統計学的事項
主要評価項目:全生存期間
本試験はゲムシタビン群の生存期間中央値を8ヶ月、ゲムシタビン+シスプラチン群の生存期間中央値を11ヶ月となることを検証する優越性試験として設計され、 3年間の登録・最終登録から6ヶ月間の経過観察期間のもと、検出力80%、両側α=0.05として、354例の登録・315イベントが必要と設定された。脱落例を見込んで、400例の登録を目標とした。試験結果:
- 2002年2月から2008年10月に英国の37施設で410例が登録された。
- 全例がITT解析の対象となり、安全性については、未投与症例を除いたゲムシタビン+シスプラチン群198例、ゲムシタビン群199例を対象に解析された。
- 観察期間中央値は8.2ヶ月、327例の死亡発生時点で解析された。
- 患者背景に、大きな隔たりは認められなかった。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.64 (95%C.I. 0.52-0.80) p<0.001 |
|
| ゲムシタビン+シスプラチン | 11.7ヶ月 | 9.5-14.3 | |
| ゲムシタビン | 8.1ヶ月 | 7.1-8.7 |
2. 無増悪生存期間
| 中央値 | 95%信頼区間 | HR 0.63 (95%C.I. 0.51-0.77) p<0.001 |
|
| ゲムシタビン+シスプラチン | 8.0ヶ月 | 6.6-8.6 | |
| ゲムシタビン | 5.0ヶ月 | 4.0-5.9 |
3. 病勢制御割合
| 病態制御割合 | p=0.049 | |
| ゲムシタビン+シスプラチン | 81.4% | |
| ゲムシタビン | 71.8% |
4. 有害事象(Grade 3以上, NCI-CTCAE ver 3.0)
| ゲムシタビン | ゲムシタビン+シスプラチン | p値 | |
|---|---|---|---|
| 血液毒性 | 47 (23.6%) | 64 (32.3%) | 0.05 |
| 白血球減少 | 19 (9.5%) | 31 (15.7%) | 0.07 |
| 血小板減少 | 13 (6.5%) | 17 (8.6%) | 0.44 |
| 貧血 | 6 (3.0%) | 15 (7.6%) | 0.04 |
| 好中球減少 | 33 (16.6%) | 50 (25.3%) | 0.03 |
| 非血液毒性 | 100 (50.3%) | 108 (54.3%) | 0.39 |
| 脱毛 | 0 | 2 (1.0%) | 0.16 |
| 食欲不振 | 5 (2.5%) | 6 (3.0%) | 0.75 |
| 疲労 | 33 (16.6%) | 37 (18.7%) | 0.58 |
| 悪心 | 7 (3.5%) | 8 (4.0%) | 0.78 |
| 嘔吐 | 11 (5.5%) | 10 (5.1%) | 0.65 |
| 腎機能障害 | 2 (1.0%) | 3 (1.5%) | 0.83 |
| 発熱性好中球減少症 | 14 (7.0%) | 20 (10.1%) | 0.28 |
結語
結語:進行胆道癌において、ゲムシタビン+シスプラチン併用療法はゲムシタビン単剤に比べて、有意に生存期間を延長した。ゲムシタビン+シスプラチン併用療法は、進行胆道癌の標準治療の一つである。
執筆:神奈川県立がんセンター 消化器内科 肝胆膵 医長 小林 智 先生
監修:神奈川県立がんセンター 消化器内科 肝胆膵 医長 上野 誠 先生
監修:神奈川県立がんセンター 消化器内科 肝胆膵 医長 上野 誠 先生