| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胆道癌 | 補助化学療法 | 第3相 | 全生存期間 | 海外 (イギリス) |
なし |
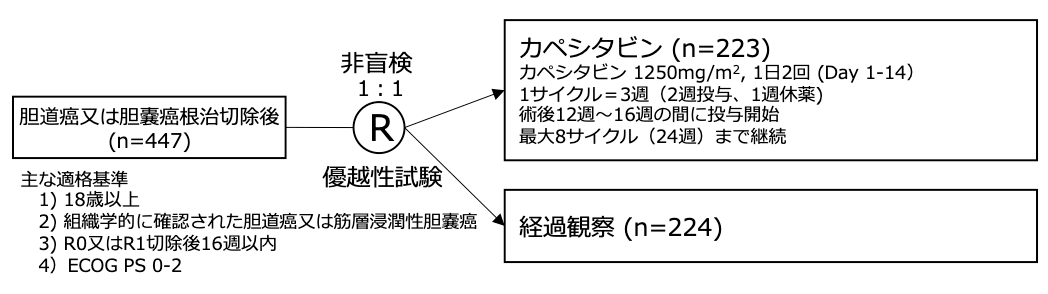
試験名 :BILCAP
レジメン:カペシタビン vs 経過観察
登録期間:2006年3月〜2014年12月
背景
胆道癌は5年生存割合は10%を下回る極めて予後不良な疾患であり、根治的切除の対象となる患者はわずか20%である。根治切除が行われた患者に対する術後補助化学療法として、塩酸ゲムシタビン単独投与や塩酸ゲムシタビン及びオキサリプラチン併用投与が試みられたが、術後補助化学療法の有用性を示した報告はこれまでにない。
カペシタビンは経口のフッ化ピリミジン系薬剤であり、単独又は他剤との併用で、大腸癌、食道癌、胃癌、膵癌の術後補助化学療法として有用性が示されている。今回、胆道癌の術後補助化学療法として、カペシタビンの有用性を検討する非盲検第3相比較試験(BILCAP試験)が行われた。
カペシタビンは経口のフッ化ピリミジン系薬剤であり、単独又は他剤との併用で、大腸癌、食道癌、胃癌、膵癌の術後補助化学療法として有用性が示されている。今回、胆道癌の術後補助化学療法として、カペシタビンの有用性を検討する非盲検第3相比較試験(BILCAP試験)が行われた。
シェーマ
統計学的事項
主要評価項目:全生存期間
本試験は経過観察群を対照として、カペシタビン群及び経過観察群の24ヵ月生存割合がそれぞれ32%及び20%と仮定し、カペシタビン群の全生存期間のハザード比が0.71となることを検証する優越性試験として設計され、検出力80%、両側α=0.05として、360例の登録・270イベントが必要と設定された。しかし、364例の登録が終了した時点で当初想定していたイベント数よりも明らかに少ないことから、独立モニタリング委員会は、カペシタビン群及び経過観察群の24ヶ月生存割合がそれぞれ71%及び60% (ハザード比0.69)となることが見込まれる234イベントが発生した時点で最終解析を行うことを勧告した。試験結果:
- 2006年3月から2014年12月の間にイギリスの44施設から447例が登録され、223例がカペシタビン群に、224例が経過観察群に割付られた。
- ITT解析は全例を対象とした。
- Per-protocol解析はカペシタビン群210例、経過観察群220例を対象とした(カペシタビン群の14例、経過観察群の4例を、不適格または未治療などで除外した)。
- 独立モニタリング委員会より勧告された24ヶ月生存割合(カペシタビン群71%、経過観察群60%)には2017年1月に到達し、2017年3月6日にデータカットオフを行った。観察期間中央値は60ヶ月であった。
- 患者背景に、大きな隔たりは認められなかった。
1. 全生存期間 ITT解析(主要評価項目)
| 中央値 | 95%信頼区間 | Adjusted HR 0.71 (95%C.I. 0.55-0.92) p=0.010 |
|
| カペシタビン(n=223) | 51.1ヶ月 | 34.6-59.1 | |
| 経過観察(n=224) | 36.4ヶ月 | 29.7-44.5 |
2. 全生存期間 per protocol解析(主要評価項目)
| 中央値 | 95%信頼区間 | Adjusted HR 0.75 (95%C.I. 0.58-0.97) p=0.028 |
|
| カペシタビン(n=210) | 53ヶ月 | 40-not reached | |
| 経過観察(n=220) | 36ヶ月 | 30-44 |
3. 無再発生存期間 ITT解析
| 中央値 | 95%信頼区間 | Adjusted HR 0.75 (95%C.I. 0.58-0.98) p=0.033 |
|
| カペシタビン(n=223) | 24.4ヶ月 | 18.6-35.9 | |
| 経過観察(n=224) | 17.5ヶ月 | 12.0-23.8 |
4. 無再発生存期間 Per-protocol解析
| 中央値 | 95%信頼区間 | Adjusted HR 0.70 (95%C.I. 0.54-0.92) p=0.0093 |
|
| カペシタビン(n=210) | 25.9ヶ月 | 19.8-46.3 | |
| 経過観察(n=220) | 17.4ヶ月 | 12.0-23.7 |
5. 有害事象 カペシタビン群
| カペシタビン (n=213) | ||
|---|---|---|
| Grade 1/2 | Grade 3 | |
| 手足症候群 | 127 (60%) | 43 (20%) |
| 疲労 | 159 (75%) | 16 (8%) |
| 下痢 | 121 (57%) | 16 (8%) |
| 嘔気 | 106 (50%) | 2 (1%) |
| 口腔粘膜炎,口内炎 | 94 (44%) | 2 (1%) |
| 腹痛 | 61 (29%) | 10 (5%) |
| 嘔吐 | 49 (23%) | 1 (<1%) |
| 好中球・顆粒球 | 45 (21%) | 4 (2%) |
| ビリルビン | 42 (20%) | 3 (1%) |
| 皮疹・落屑 | 31 (15%) | 2 (1%) |
| 発熱 | 30 (14%) | 1 (<1%) |
| 血小板数減少 | 25 (12%) | 1 (<1%) |
- カペシタビン群ではこの他にGrade 4の心虚血または心筋梗塞が1例(<1%)認められた。Grade 5は報告されていない。
- 経過観察群では有害事象の情報は収集されなかった。
結語
根治切除後の胆道癌患者に対するカペシタビンによる術後補助化学療法は、ITT解析では主要評価項目である全生存期間を延長させなかった。ただし、事前に設定したPer-protocolの解析対象集団における解析では、全生存期間を統計学的有意に延長させており、標準治療となりうる。
執筆:金沢大学 消化器内科 寺島 健志先生
監修:神奈川県立がんセンター 消化器内科(肝胆膵) 部長 上野 誠 先生
監修:神奈川県立がんセンター 消化器内科(肝胆膵) 部長 上野 誠 先生