| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胆道癌 | 一次治療もしくは 二次治療以降 |
第1相 | 安全性 | 日本 | あり |
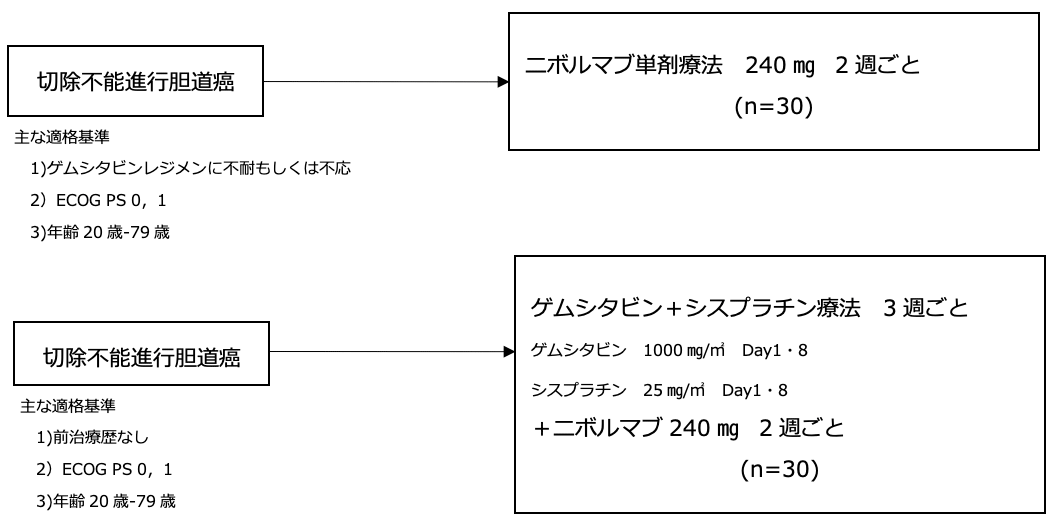
試験名 :なし
レジメン:ニボルマブ単剤 もしくはゲムシタビン+シスプラチン+ニボルマブ
登録期間:2016年1月13日〜 2017年4月19日
背景
切除不能・再発胆道癌における標準治療はゲムシタビン+シスプラチン療法(GC療法)である。しかし、GC療法の治療効果は十分なものではなく、より効果的な治療とその他の選択肢が求められている。さらに二次治療として確立したものはない。他癌種において、PD-L1発現のある腫瘍では免疫チェックポイント阻害薬の有効性が示されており、胆道癌でもPD-L1発現より、有効性が期待される。そのため、胆道癌に対して一次治療としてGC療法+ニボルマブ(NIVO)と二次治療以降としてのNIVO単剤療法の安全性を検討する第1相試験が行われた。
シェーマ
統計学的事項
主要評価項目:安全性評価
サンプルサイズの設定に関して、早期に重篤な治療関連有害事象発生割合を評価するために80%以上の正確性を担保するためには少なくとも15例の登録が必要であり、50例まで登録実施できるデザインとした。試験結果:
- 2016年1月13日~2017年4月19日の間にNIVO単剤療法群とGC療法+NIVO群のそれぞれに30人の患者登録がされ、2017年8月31日にデータカットオフが行われた。
- 安全性の評価は両群で30例全例に実施された。
1. 有害事象(主要評価項目)
- NIVO単剤療法群では57%(17/30)にすべてのGradeの治療関連有害事象を認め、Grade3以上の治療関連有害事象は10%(3/30)であった。
- GC療法+NIVO群ではすべての症例に治療関連有害事象を認め、Grade3以上の治療関連有害事象は90%(27/30)に認めた。
| NIVO単剤療法群(N=30) | GC療法+NIVO群(N=30) | ||||
|---|---|---|---|---|---|
| Grade 1-2 | Grade 3 | Grade 1-2 | Grade 3 | Grade 4 | |
| 食欲不振 | 5(17%) | 0 | 10(33%) | 3(10%) | 0 |
| 倦怠感 | 4(13%) | 0 | 8(27%) | 0 | 0 |
| 掻痒感 | 4(13%) | 0 | 4(13%) | 0 | 0 |
| 皮疹 | 2(7%) | 1(3%) | 5(17%) | 0 | 0 |
| 発熱 | 2(7%) | 0 | 8(27%) | 0 | 0 |
| 筋肉痛 | 2(7%) | 0 | 5(17%) | 0 | 0 |
| 疲労 | 1(3%) | 0 | 8(27%) | 0 | 0 |
| 悪心 | 1(3%) | 0 | 11(37%) | 0 | 0 |
| 嘔吐 | 1(3%) | 0 | 3(10%) | 0 | 0 |
| 好中球減少 | 1(3%) | 0 | 16(53%) | 21(70%) | 13(43%) |
| 血小板減少 | 0 | 0 | 22(73%) | 13(43%) | 6(20%) |
| 白血球減少 | 1(3%) | 0 | 18(60%) | 13(43%) | 1(3%) |
| AMY上昇 | 0 | 1(3%) | 0 | 0 | 0 |
| 斑状丘疹 | 0 | 1(3%) | 1(3%) | 0 | 0 |
| 貧血 | 0 | 0 | 5(17%) | 14(47%) | 0 |
| 末梢神経障害 | 0 | 0 | 6(20%) | 0 | 0 |
| 脱毛 | 0 | 0 | 5(17%) | 0 | 0 |
| 胃炎 | 0 | 0 | 5(17%) | 0 | 0 |
| 便秘 | 0 | 0 | 3(10%) | 0 | 0 |
| クレアチン上昇 | 0 | 0 | 3(10%) | 0 | 0 |
| 味覚障害 | 0 | 0 | 3(10%) | 0 | 0 |
| 浮腫 | 0 | 0 | 3(10%) | 0 | 0 |
| しゃっくり | 0 | 0 | 3(10%) | 0 | 0 |
| リンパ球減少 | 0 | 0 | 1(3%) | 1(3%) | 0 |
| 蛋白尿 | 0 | 0 | 1(3%) | 1(3%) | 0 |
| 発熱性好中球減少 | 0 | 0 | 0 | 2(7%) | 0 |
| アナフィラキシー | 0 | 0 | 0 | 1(3%) | 0 |
| 心筋炎 | 0 | 0 | 0 | 1(3%) | 0 |
2. 全生存期間
| 中央値 | 95%信頼区間 | |
|---|---|---|
| NIVO単剤療法群(N=30) | 5.2ヶ月 | 4.5‐8.7ヶ月 |
| GC療法+NIVO群(N=30) | 15.4ヶ月 | 11.8ヶ月‐未到達 |
3. 無増悪生存期間
| 中央値 | 95%信頼区間 | |
|---|---|---|
| NIVO単剤療法群(N=30) | 1.4ヶ月 | 1.4‐1.4ヶ月 |
| GC療法+NIVO群(N=30) | 4.2ヶ月 | 2.8‐5.6ヶ月 |
4. 奏効割合
| 中央値 | 95%信頼区間 | |
|---|---|---|
| NIVO単剤療法群(N=30) | 3% | 0.7‐13.6% |
| GC療法+NIVO群(N=30) | 37% | 23.9‐51.7% |
5. サブ解析
・腫瘍内PD-L1発現
| NIVO単剤療法群 | GC療法+NIVO群 | |||
|---|---|---|---|---|
| PD-L1<1% | PD-L1≧1% | PD-L1<1% | PD-L1≧1% | |
| N | 23例 | 5例 | 21例 | 8例 |
| 全生存期間 | 5.2ヶ月(4.1‐8.7) | 11.6ヶ月(2.0‐NE) | 15.4ヶ月(11.0‐NE) | 11.8ヶ月(5.5‐NE) |
| 無増悪生存期間 | 1.4ヶ月(1.4‐1.4) | 2.8ヶ月(0.2‐NE) | 4.1ヶ月(1.5‐5.6) | 4.7ヶ月(2.8‐7.9) |
| 奏効割合 | 0%(0‐10.5) | 20%(4.6‐56.5%) | 29%(15.6‐46.5%) | 50%(24.9‐75.1%) |
(90% 信頼区間)
・腫瘍関連免疫細胞PD-L1発現
| NIVO単剤療法群 | GC療法+NIVO群 | |||
|---|---|---|---|---|
| PD-L1<1% | PD-L1≧1% | PD-L1<1% | PD-L1≧1% | |
| N | 10例 | 18例 | 10例 | 18例 |
| 全生存期間 | 4.3ヶ月(3.1‐6.4) | 8.7ヶ月(4.6‐11.6) | 15.4ヶ月(5.7‐15.4) | NE(11.8ヶ月‐NE) |
| 無増悪生存期間 | 1.4ヶ月(1.1‐3.4) | 1.4ヶ月(1.4‐1.5) | 4.1ヶ月(1.4‐4.4) | 4.3ヶ月(2.8‐7.9) |
| 奏効割合 | 0%(0‐21.3) | 6%(1.2‐21.5%) | 20%(6.9‐45.9%) | 44%(27.2‐63.1%) |
(90% 信頼区間)
結語
- NIVO単剤療法群およびGC療法+NIVO群では日本人の進行再発胆道癌に対する安全性が確認された。
- 進行再発胆道癌に対するNIVO単剤療法およびGC療法+NIVO治療は抗腫瘍効果がある可能性が示された。
- PD-L1発現は胆道癌治療に対するNIVO治療のバイオマーカーの可能性がある。
執筆:国立がん研究センター中央病院 肝胆膵内科 医員 丸木 雄太 先生
監修:神奈川県立がんセンター病院 消化器内科 肝胆膵 部長 上野 誠 先生
監修:神奈川県立がんセンター病院 消化器内科 肝胆膵 部長 上野 誠 先生