| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 進行/再発胆道癌 | 二次治療以降 | 第2相 | 奏効割合 | 国際 | あり |
試験名 :ROAR basket trial
レジメン:ダブラフェニブ+トラメチニブ
登録期間:2014年3月〜2018年6月
背景
ダブラフェニブ(DAB)はBRAF V600E遺伝子変異を標的とした分子標的薬であり、BRAF V600E遺伝子変異陽性の悪性黒色腫においてすでに有用性が示されており、MEK阻害剤であるトラメチニブ(TRA)との併用療法が、悪性黒色腫において標準療法の1つとなっている1)。BRAF V600E遺伝子変異陽性であれば、他癌種においてもDABとTRAの併用療法の有効性が期待され、実際に未分化甲状腺癌、および非小細胞肺癌では有効性が示されている。胆道癌におけるBRAF V600E遺伝子変異陽性率は5~7%2),3)と報告され、予後不良である胆道癌においても、BRAF V600E遺伝子変異は治療標的として期待されている。ROAR basket trialはBRAF V600E遺伝子変異陽性固形癌に対するDAB+TRA併用療法の第2相試験であり、胆道癌コホートの結果が発表された。
シェーマ
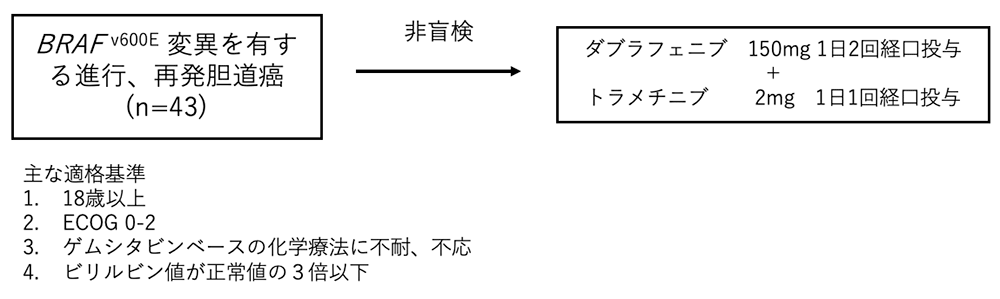
統計学的事項
主要評価項目:奏効割合
主要評価目的はRECISTv1.1に基づく中央判定、ならびに施設判定の奏効割合であり、1次コホートは最大25例を登録するように計画された。期待奏効割合を50%、ヒストリカルコントロールにおける閾値奏効割合を10%、検出力84-98%、α<0.05と設定された。試験結果:
- 2014年3月から2018年7月までの間に、626人の胆道癌患者を対象に、BRAF V600E変異のプレスクリーニングを実施し、57人のBRAF V600E変異を有する胆道癌患者が同定され、そのうち43人が本試験に登録された。観察期間中央値は10か月であった。
- 原発は肝内胆管39人(91%)、胆嚢1人(2%)、肝門部領域1人(2%)であった。
1. 奏効割合(主要評価項目)
| DAB+TRA | 95%信頼区間 | |
|---|---|---|
| 中央判定 | 20人(47%) | 31-62% |
| 施設判定 | 22人(51%) | 36-67% |
2. 全生存期間
| 中央値 | 95%信頼区間 | |
|---|---|---|
| DAB+TRA | 14ヶ月 | 10-33ヶ月 |
3. 無増悪生存期間
| 中央値 | 95%信頼区間 | |
|---|---|---|
| DAB+TRA | 9ヶ月 | 5-10ヶ月 |
4. 有害事象(CTCAE ver.4.0) Grade3以上が5%以上出現した主なものを以下に記載する
| DAB+TRA (N=43) | ||
|---|---|---|
| Grade 1-2 | Grade 3以上 | |
| GGT上昇 | 7 (16%) | 5 (12%) |
| 白血球減少 | 7 (16%) | 3 (7%) |
| 高血圧 | 2 (5%) | 3 (7%) |
| 低ナトリウム血症 | 2 (5%) | 3 (7%) |
| AST上昇 | 9 (21%) | 2 (5%) |
| ALP上昇 | 7 (16%) | 2 (5%) |
| 高血糖 | 6 (14%) | 2 (5%) |
| 胆管炎 | 2 (5%) | 2 (5%) |
| 体重減少 | 2 (5%) | 2 (5%) |
| ビリルビン上昇 | 1(2%) | 2 (5%) |
| 好中球減少 | 1(2%) | 2 (5%) |
GGT:γ-グルタミルトランスフェラーゼ
- 重篤な有害事象は17人(40%)そのうちで9人(21%)が治療に関連と考えられた(最も多かったのは発熱で、8人(19%)で発生した)。2人(5%)が敗血症で死亡したが、これは本試験の治療と因果関係なしと判断された。
結語
BRAF V600E遺伝子変異陽性胆道癌に対して、DAB+TRA併用療法は忍容可能な毒性と有望な治療効果が認められた。この結果から、進行、再発胆道癌において、BRAF V600Eは検索すべき遺伝子変異であると言える。
関連論文
1) Robert C, et al. Improved overall survival in melanoma with combined dabrafenib and trametinib, N Engl J Med. 372(1): 30-39, 2015. [Pubmed]
2) Siegel RL, et al. Cancer statistics, 2015, CA Cancer J Clin. 65(1): 5-29, 2015. [Pubmed]
3) Valle J, et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer, N Engl J Med. 362(14): 1273-1281, 2010. [Pubmed]
執筆:国立がん研究センター東病院 肝胆膵内科 がん専門修練医 大鶴 徹 先生
監修:神奈川県立がんセンター 消化器内科 肝胆膵 部長 上野 誠 先生
監修:神奈川県立がんセンター 消化器内科 肝胆膵 部長 上野 誠 先生