| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 手術可能なHER2陽性早期乳がん | 術後 | 第3相 | 無浸潤性疾患生存期間(IDFS) | 国際 | あり |
試験名 :APHINITY
レジメン:ペルツズマブ(PER)+トラスツズマブ (HER)+化学療法
登録期間:2011年11月~2013年8月
背景
シェーマ
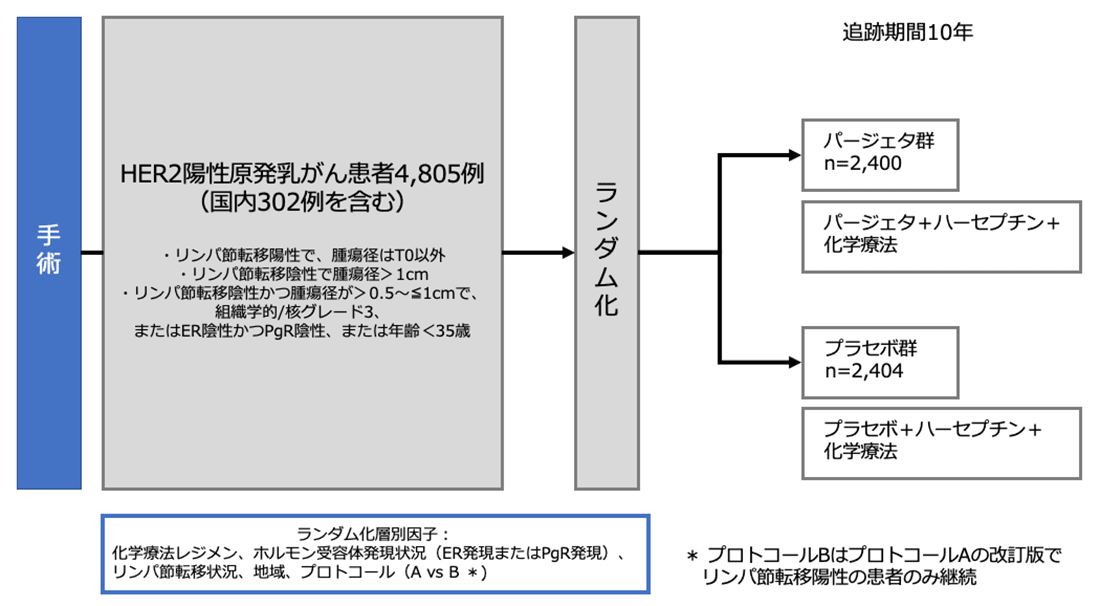
試験結果:
計4,804例のうち、2,400例がHER+化学療法にPERを投与する群(PER群)、2,404例がプラセボ群に無作為に割り付けられた。リンパ節転移陽性例はPER群62.6%、placebo群62.4%、ホルモン受容体陰性例はPER群36.0%、プラセボ群35.7%であった。化学療法のレジメンとしては、5-フルオロウラシル+エピルビシンまたはドキソルビシン+シクロホスファミド(FEC, FAC療法またはAC療法)を2週間あるいは3週間ごとに3サイクルまたは4サイクル投与した後、ドセタキセル+HERを3週間ごとに3サイクルまたは4サイクル投与するか、パクリタキセル+HERを12週間ごとに投与する方法、もしくは、ドセタキセル+カルボプラチン+HERを6サイクル(3週間ごと)が選択された。(AC/dose dense AC/FEC/FAC→HP+ triweekly DTX/ weekly PTXあるいはTCbHP)
主要評価項目: IDFS(乳癌以外の続発性原発癌をイベントとして含まない、具体的にはランダム化時点から以下のイベント初発までの期間)
データカットオフXXXX年XX月XX日時点の無浸潤疾患生存期間(IDFS)イベントはPER群で171人(7.1%)、プラセボ群では210人(8.7%)に報告された。3年IDFSはPER群 94.1%、プラセボ群 93.2%であり、ハザード比は 0.81(95%信頼区間[CI]、0.66~1.00、P=0.045)でPER群が統計学的有意に良好であった。最初のIDFSイベントとして遠隔再発が発生したのは、PER群で112名(4.7%)、プラセボ群で139名(5.8%)、局所再発はそれぞれ26名(1.1%)、34名(1.4%)であった。IDFSイベントのうち、中枢神経系の転移によるものは、がペルツズマブ群では1.9%、プラセボ群では1.8%であった。
サブグループ解析において、リンパ節転移陰性の患者集団ではPERの追加による治療効果は検出されなかった(ハザード比1.13、95%CI、0.68~1.86、P=0.64)。一方、リンパ節転移陽性の患者集団では、3年IDFSはハザード比0.77、95%CI、0.62〜0.96、P=0.02であった。ホルモン受容体陰性のコホートでは、3年IDFSはPER群で92.8%、プラセボ群で91.2%(ハザード比0.76、95%CI、0.56〜1.04、P=0.08)、ホルモン受容体陽性患者の試験デザインでは3年IDFSはPER群で94.8%、プラセボ群で94.4%(ハザード比、0.86;~1.13;P=0.28)であったPER追加による治療効果に対する影響を多変量解析で検討した結果、リンパ節転移の有無やホルモン受容体の有無に基づくものを含め、検討したどのサブグループでも有意ではなかった。3年後までにIDFSイベントを回避する絶対的リスクに基づく治療必要数(NNT;number needed to treat)は、全集団で112人、リンパ節陽性集団で56人、ホルモン受容体陰性集団で63人であった。
副次評価項目: 乳癌以外の続発性原発癌をイベントとして含むIDFS、無病生存期間(DFS)、全生存期間(OS)、再発までの期間、遠隔再発までの期間、健康関連QOL(HRQOL)、心臓関連の安全性、全般的安全性
乳癌以外の2次原発がんの発生をIDFSの解析に含めると、イベントが発生した患者数はPER群で189人、プラセボ群で230人に増加し、有意な群間差が生じた(ハザード比、0.82、95%CI、0.68~0.99、P=0.04)。
全生存期間
| ペルツズマブ群(n=2,400) | プラセボ群(n=2,404) | |
|---|---|---|
| イベント数 | 125(5.2%) | 147(6.1%) |
| 層別ハザード比(95%CI) | 0.85(0.67-1.07) | |
| P値 | 0.170 | |
| 追跡期間中央値 | 74.1ヵ月 | |
| イベント率差(95%CI) | 0.9%(-0.5-2.2) | |
- 安全性については、心不全や心臓死、および心機能障害は両群ともに稀であった。グレード3以上の下痢は、ほぼ化学療法中にのみ発生し、PER群はプラセボ投与群よりも頻度が高かった(9.8% vs. 3.7%)。
有害事象の概要
| n(%) | パージェタ群(n=2,364) | プラセボ群(n=2,405) |
|---|---|---|
| 全有害事象 | 2,361(99.9) | 2,392(99.5) |
| Grade3以上(CTCAE ver 4.0) | 1,518(64.2) | 1,379(57.3) |
| 重篤な有害事象 | 692(29.3) | 585(24.3) |
| いずれかの試験薬の中止に至った有害事象 | 309(13.1) | 277(11.5) |
| 用量変更に至った有害事象 | 1,217(51.5) | 1,064(44.2) |
| 全死亡 | 73(3.1) | 95(4.0) |
| 死亡に至った有害事象 | 10(0.4) | 14(0.6) |
プラセボ群の 3年IDFS 93.2%は事前に想定されていた89.2%よりも高く、主要解析に必要なイベント数に到達するまでに予想以上の時間がかかった。今回の主要解析における追跡期間の中央値は45.4ヵ月で、特にホルモン受容体陽性またはリンパ節陰性の患者のコホートでは、効果の大きさを完全に評価するには短すぎる可能性がある。2022年に計画されているOSの3回目の中間解析まで試験は継続され、最低でも10年間のフォローアップののち、解析される予定となっている。
監修:国立国際医療研究センター病院 乳腺・腫瘍内科 下村 昭彦 先生