| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| HER2陽性転移性乳癌 | 一次治療 | 第3相 | 無増悪生存期間 | 国際 | あり (N=53) |
試験名 :CLEOPATRA
レジメン:ドセタキセル+トラスツズマブ+ペルツズマブvs ドセタキセル+トラスツズマブ
登録期間:2008年2月12日〜2010年7月7日
背景
シェーマ
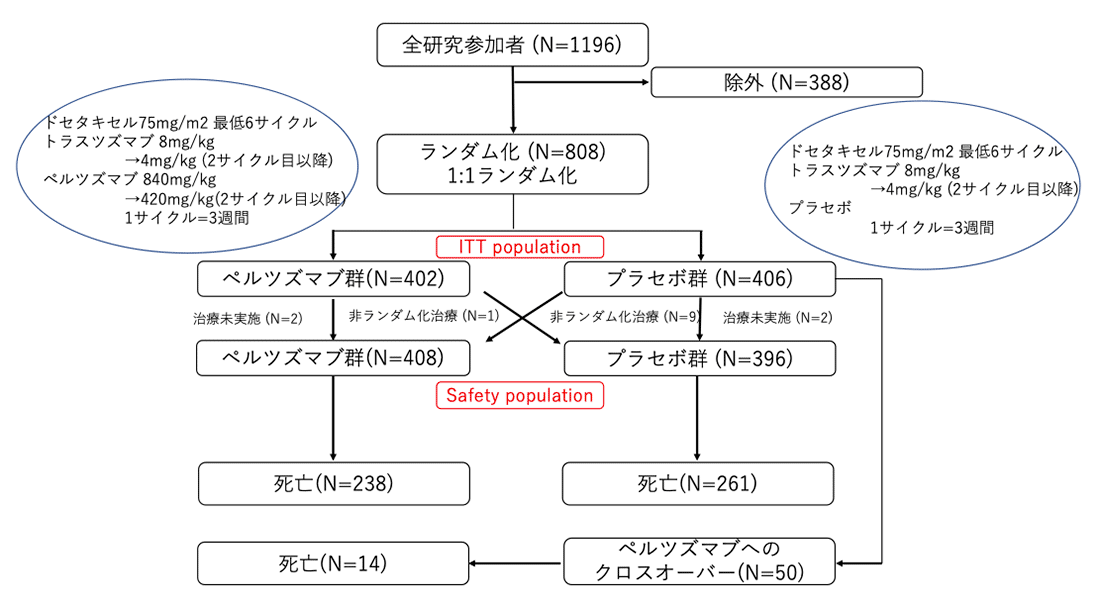
シェーマ注) 安全に投与できた場合、ドセタキセルは75mg/m2から100mg/m2に増量することも可能であった
主な適格条件
- 化学療法歴のないHER2陽性の切除不能、局所再発または転移再発乳癌患者
- HER2陽性の定義:中央判定でIHC法 3+またはFISH法でHER2/CEP17比が2.0以上
- 18歳以上
- 心臓超音波検査で左室駆出率 (LVEF) 50%以上
- ECOG PS 0または1
- ホルモン受容体陽性の場合は、前治療としてのホルモン治療は1ラインまで許容された
- 周術期化学療法 (トラスツズマブも含む)を実施した患者は、治療終了から再発まで12ヶ月以上の間隔があれば許容された
- 中枢神経系への転移がある場合、ドキソルビシン換算で累計360mg/m2以上のアンスラサイクリン系抗癌剤による治療歴がある場合、前治療としてのトラスツズマブ治療中にLVEFが50%未満になったことがある場合、またコントロール不良の合併症を有する場合は不適格となった
主要評価項目:無増悪生存期間 (中央独立評価)
副次評価項目:全生存期間、無増悪生存期間 (主治医評価)、奏効割合、安全性
統計設定:
本試験はプラセボ群に対してペルツズマブ群の主要評価項目である無増悪生存期間のハザード比が0.75となることを検証する優越性試験として設計され、検出力は80%、両側αは0.05として800例の登録、381例のイベントが必要とされた。主要評価項目である無増悪生存期間の解析時に、全生存期間の中間解析が実施された。中間解析はO’Brien-Fleming法による消費関数により計算された有意水準を用いて実施された。全生存期間の中間解析で予め設定された停止境界を超えなかった場合は、385例の死亡確認後に行われる最終解析まで試験を継続することとなった。全生存期間については検出力80%でペルツズマブ群で33%の生存延長の改善がみられるかを検証するように設定された。無増悪生存期間、全生存期間、奏効割合はintention-to-treat解析での評価が行われた。安全性評価は1 サイクル以上の実際の治療を実施したコホートをsafety populationとして解析された。
試験結果:
2008年2月から2010年7月までの期間で、25カ国204施設から808人の患者が登録された。1:1ランダム化で402人がペルツズマブ群、406人がプラセボ群に割り付けられた。ベースラインの患者背景は2群間で大きな差はみられず、年齢中央値は54歳、アジア人は全体の3割、ホルモン受容体陽性は約半数で、HER2のIHCは9割程度で3+であった。
主要評価項目:
独立中央判定での無増悪生存期間の中央値はペルツズマブ群で18.5ヶ月、プラセボ群で12.4ヶ月(ハザード比0.62、p<0.001)であり、ペルツズマブ群で統計学的に有意に無増悪生存期間の延長がみられた。
サブグループ解析では、周術期化学療法の有無によらずペルツズマブ群で無増悪生存期間の統計学的に有意な延長がみられた。また、トラスツズマブを含まない周術期化学療法を実施したコホート(288例)ではペルツズマブの上乗せは統計学的に有意に無増悪生存期間を延長し (21.6ヶ月 vs 12.6ヶ月、ハザード比0.60 (95%CI 0.43-0.83))、トラスツズマブを含む周術期化学療法を実施したコホート(88例)においても、統計学的に有意ではなかったがペルツズマブ群で有利な傾向であった(16.9ヶ月 vs 10.4ヶ月、ハザード比0.62 (95%CI 0.35-1.07))。
副次評価項目:
全生存期間:初回中間解析の時点で165例の死亡イベントが確認されており、フォローアップ期間中央値は19.3ヶ月で、全生存期間のハザード比0.64、p=0.005であった。中間解析時の中止基準(ハザード比≦0.603、p≦0.0012)を満たさなかったため、統計学的な有意差ではなかったが、ペルツズマブ群で有利な傾向であった。267例の死亡イベントが確認された2回目の中間解析では、ペルツズマブ群で29.7ヶ月、プラセボ群で30.1ヶ月のフォローアップ期間において、全生存期間中央値はペルツズマブ群で未到達、プラセボ群で37.6ヶ月であった。ハザード比 0.66、p=0.0008であり、中間解析における閾値を満たしたため、統計学的有意差をもってペルツズマブ群で全生存期間を延長する結果が得られた。中間解析で全生存期間の統計学的な延長が確認された結果、2012年7月以降は二重盲検は解除し、プラセボ群で病勢進行を認めなかった患者はペルツズマブのクロスオーバーが認められ、プラセボ群の患者の内50例でペルツズマブの投与が行われた。
2014年2月に389例の死亡が確認された時点での解析では全生存期間の中央値はペルツズマブ群で56.5ヶ月、プラセボ群で40.8ヶ月 (ハザード比0.68、p<0.001)であり、ペルツズマブの上乗せにより15.7ヶ月の生存延長が認められた。約8年のフォローアップ期間が経過した2018年11月の最終報告では、全生存期間は57.1ヶ月 vs 40.8ヶ月 (ハザード比0.69、p<0.0001)であった。8年生存率はそれぞれ37%、23%であった。
無増悪生存期間 (主治医評価):ペルツズマブ群で18.7ヶ月、プラセボ群で12.4ヶ月であり、主要評価項目で検証された独立中央判定での無増悪生存期間と同様に、ペルツズマブ群で統計学的に有意に良好であった(ハザード比 0.69、 p=0.001)。
奏効割合:ペルツズマブ群で80.2% (CR 5.5%、PR 74.6%)、プラセボ群で69.3% (CR 4.2%、PR 65.2%)であり、ペルツズマブ群で統計学的に有意に良好であった(p=0.001)。治療サイクル中央値はペルツズマブ群で24サイクル、プラセボ群で15サイクルであり、両群ともドセタキセルは8サイクル実施された。
安全性:
ペルツズマブ群での有害事象として、下痢、皮疹、掻痒症などの頻度がプラセボ群より高かった。グレード3以上の好中球数減少はペルツズマブ群の49%、プラセボ群の46%でみられた。心機能への影響については、左室収縮機能不全はペルツズマブ群で5%、プラセボ群で9%でみられ、LVFFが50%未満かつベースラインから10%以上低下した割合はそれぞれ5%、7%であり、ペルツズマブの上乗せによる心機能障害の頻度増加は認めなかった。
監修:虎の門病院 臨床腫瘍科 医長 田辺 裕子 先生