| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 乳癌 | 術後 | 第3相 | 無増悪生存 | 日本・韓国 | あり |
試験名 :CREATE-X
レジメン:カペシタビン
登録期間:2007年2月〜2012年7月
背景
シェーマ
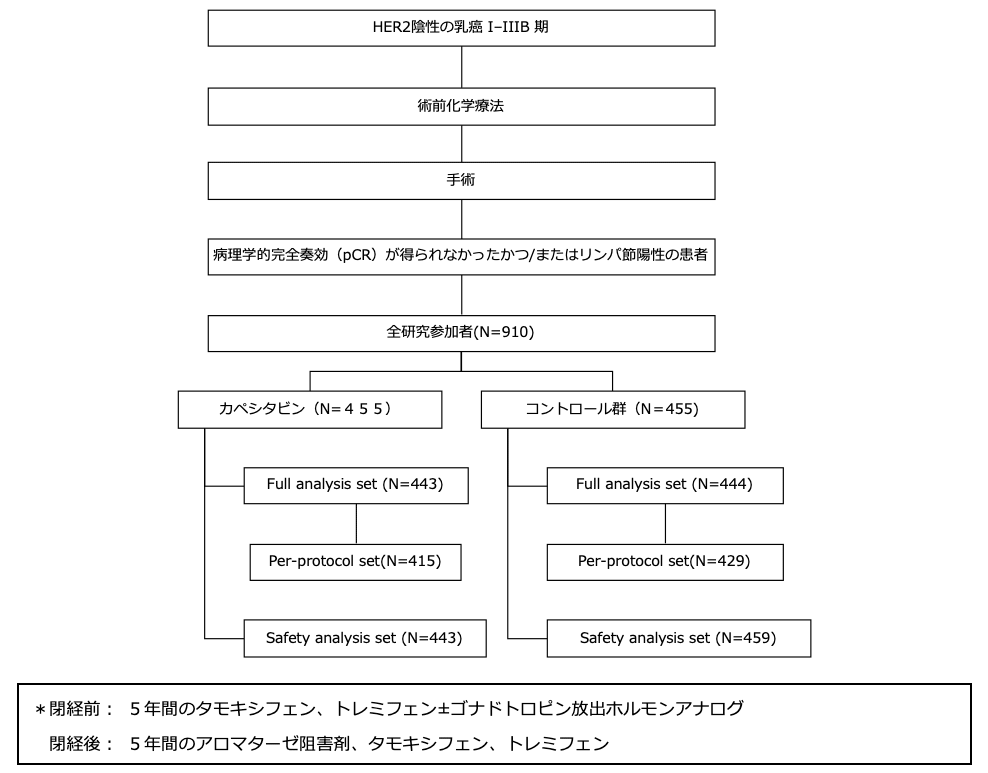
主な適格条件
- HER2陰性のI期からIIIB期の乳癌で標準的な術前化学療法(アントラサイクリン系かつ/またはタキサン系抗癌剤)を受けて、病理学的完全奏効(pCR)*が得られなかったかつ/またはリンパ節陽性の患者
- 年齢20歳〜74歳
- ECOG PS 0〜1
*非浸潤性乳管癌(ductal carcinoma in situ;DCIS)はpCRと判定
主な除外基準
- 両側乳癌
- 他に癌を合併している
- 経口フルオロウラシルによる治療歴があること
本試験における評価項目
主要評価項目:無増悪生存期間(Disease free survival)
無病生存期間の解析において、再発、二次性癌、死亡のハザード比を0.74と想定した。登録期間を5年、追跡期間を最長5年、β=0.2、両側α=0.05とし、試験には各群に427例の登録が必要あると算出した。900例(各群450例)の登録が計画された。なお、本試験では、患者登録終了2年後に有効性に関する中間解析を実施することが規定されていた。
副次評価項目:全生存期間(Overall survival)、安全性
試験結果:
2007年2月から2012年7月までに、日本の62施設から606名、韓国の22施設から304名の合計910名の患者が登録された。患者は、Cape投与群とコントロール群に均等に無作為に割り付けられた(各群455名)。不適格(16名)、インフォームド・コンセントの撤回(3名)、インフォームド・コンセントの違反(2名)、追跡調査不能(2名)の理由で患者を除外した後、合計887名の患者が主解析に用いるFASとして採用された(Cape群443名、対照群444名)。Cape群の患者1名は、割り当てられたCapeを投与せずにコントロール群の治療を受け、コントロール群に割り当てられた患者1名は、代わりにCapeを投与された。これらの患者は、有効性に関するintention-to-treat解析において、当初割り当てられたグループに含まれた。しかし、安全性解析では、これらの患者は実際に受けたレジメンに応じたグループに含まれた。
2010年1月、独立データ・安全性監視委員会は、Capeを6サイクル投与した最初の50人の患者の安全性に関する中間解析結果に基づき、Capeの投与を8サイクル(24週)に延長することを勧告した。その結果、159名の患者に6サイクル、283名の患者に8サイクルのCape治療が行われ、それぞれ57.9%と37.8%の患者は予定通りの用量でCape治療を完遂した。6サイクル治療において、23.9%の患者に減量が必要であり、18.2%の患者が治療を続けることが出来なかった。8サイクル治療においては、36.7%の患者に減量が必要であり、25.4%の患者が治療を続けることが出来なかった。その結果、平均dose intensityは、6サイクル投与された患者で87.9%、8サイクル投与された患者で78.7%であった。
患者背景について
患者背景は両群間で均一であった。患者の年齢中央値はCape群が48歳(25-74)、対照群が48歳(25-74)、閉経前患者はCape群が59.1%、対照群が55.9%、ステージIIIA/IIIB期はCape群が40.9%、対照群が37.4%、ホルモン受容体陽性はCape群が68.6%、対照群66.9%、リンパ節転移がない症例はCape群が39.7%、対照群が38.5%、リンパ節転移4個以上はCape群が23.0%、対照群が22.3%、Pathological-effect gradeは、grade1a/1bがCape群で53.5%、対照群で50.6%、grade2/3がCape群で42.2%、対照群で46.4%であった。術前化学療法はアントラサイクリン系、タキサン系を順に受けた患者が多く、Cape群が80.6%、対照群が83.8%だった。術後内分泌療法は閉経前患者でCape群が42.4%、対照群が39.9%、閉経後患者でCape群が24.8%、対照群は28.6%が受けていた。放射線治療は、ペシタビン群が72.5%、対照群は73.4%が受けていた。
1 主要評価項目:無増悪生存(Disease free survival)について
2015年3月11日に実施された事前に規定された中間有効性解析では、主要評価項目が満たされていたため、独立データ・安全性モニタリング委員会は、プロトコールに規定されている通り、試験の早期終了を推奨した。そのため、本試験は早期に終了し、データカットオフ日である2015年9月30日までのデータは2016年6月16日に確定し、2016年7月28日に行われた最終解析に含まれた。フォローアップの中央値は3.6年であった。最終解析の結果、5年DFS率は、Cape群が74.1%、コントロール群が67.7%で有意にCape群が良好だった(p=0.01, HR=0.70, 95% CI:0.53-0.93)。サブグループ解析では、年齢、ホルモン受容体などのすべてのサブグループで、Cape群が良い傾向にあり、トリプルネガティブ乳癌では、Cape群が69.8%、コントロール群が56.1%であり(HR=0.58,95% CI: 0.39-0.87)、ホルモン受容体陽性乳癌では、Cape群が76.4%、コントロール群が73.4%であった(HR=0.81、95% CI: 0.55-1.17)。
2 副次評価項目:全生存期間(Overall survival)について
5年OS率は、Cape群が89.2%、コントロール群が83.6%でCape群が良好だった(p=0.01,HR=0.59, 95% CI: 0.39-0.90)。サブグループ解析でも、年齢、ホルモン受容体などのすべてのサブグループで、Cape群が良好であり、トリプルネガティブ乳癌では、Cape群が78.8%、コントロール群が70.3%(HR=0.52,95% CI: 0.30-0.90)、ホルモン受容体陽性乳癌では、Cape群が93.4%、コントロール群が90.0%であった(HR=0.73、95% CI: 0.38ー1.40)。
3 副次評価項目:安全性について
Cape群では、手足症候群が最も頻度の高い有害事象であり、325名(73.4%)の患者に発生し、うち49名(11.1%)がグレード3であった。またCape投与群では、グレード3以上の副作用として、好中球減少症を6.3%、下痢を2.9%、白血球減少症を1.6%に認めた。治験責任医師がCapeに関連すると判断した重篤な有害事象は4名の患者に発生し、その内訳は、好中球減少と下痢がそれぞれ1名、心窩部痛、腹痛、下痢がそれぞれ1名であった。これらの重篤な有害事象は全て消失し、治療関連死を認めなかった。
監修:虎の門病院臨床腫瘍科 臨床腫瘍科 医長 田辺 裕子 先生