乳癌 DESTINY-Breast01
DESTINY-Breast01:Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer
S. Modi, C. Saura, T. Yamashita, et al. N Engl J Med 2020;382:610-21. [PubMed]
| 対象疾患 |
治療ライン |
研究の相 |
主要評価項目 |
実施地域 |
日本の参加 |
T-DM1治療歴のある切除不能
又は転移性のHER2陽性乳癌患者 |
三次治療以降 |
第2相 |
奏効割合 |
国際 |
あり |
試験名 :DESTINY-Breast01
レジメン:トラスツズマブ デルクステカン(T-DXd)
登録期間:2017年10月~ 2018年9月
切除不能・転移性乳がん(MBC)の約15~20%は、ヒト上皮成長因子受容体2(HER2)の過剰発現または増幅を有する。HER2陽性MBCの第一選択薬として推奨されているのは、抗HER2モノクローナル抗体であるトラスツズマブ(T-mab)とペルツズマブ(PER)をタキサン系薬剤と併用する治療法である。CLEOPATRA(Clinical Evaluation of Pertuzumab and Trastuzumab)試験では、T-mab、PER、ドセタキセル(DTX)の併用により、無増悪生存期間(progression free survival:PFS)の中央値が18.7カ月、全生存期間(OS)が56.5カ月である。標準的な二次治療としては、抗体薬物複合体であるトラスツズマブ・エムタンシン(T-DM1)がT-mabとタキサン系抗がん剤の後に投与され、客観的奏効割合43.6%(95%信頼区間[CI]、38.6~48.6)、PFS中央値9.6ヵ月という結果が得られている。しかしT-DM1投与後に統一的に受け入れられる標準治療は定義されておらず、現在用いている治療法による効果は、三次治療の奏効割合が約9~31%、PFSが約3~6カ月と、有益性が限られている。T-DXdは、T-mabと同じアミノ酸配列を持つHER2を特異的に標的とする抗ヒト化モノクローナル抗体、切断可能なテトラペプチドベースのリンカー、細胞毒性薬剤(ペイロード)として強力なトポイソメラーゼI阻害剤から構成され、良好な薬物動態プロファイルを維持しながらT-DM1よりも高い薬物対抗体比(約8対3~4)を実現した抗体薬物複合体である。T-DXdの第1相試験 (DS8201-A-J101; ClinicalTrialber, NCT02564900)では、進行したHER2陽性乳がんの患者111名にT-DXdを投与され、奏効割合は59.5%(95%CI、49.7~68.7)であった。本試験は、T-DM1の投与歴のある切除不能又は転移性HER2陽性乳がん患者を対象としたT-DXdの第2相試験(2部構成)である。
シェーマ
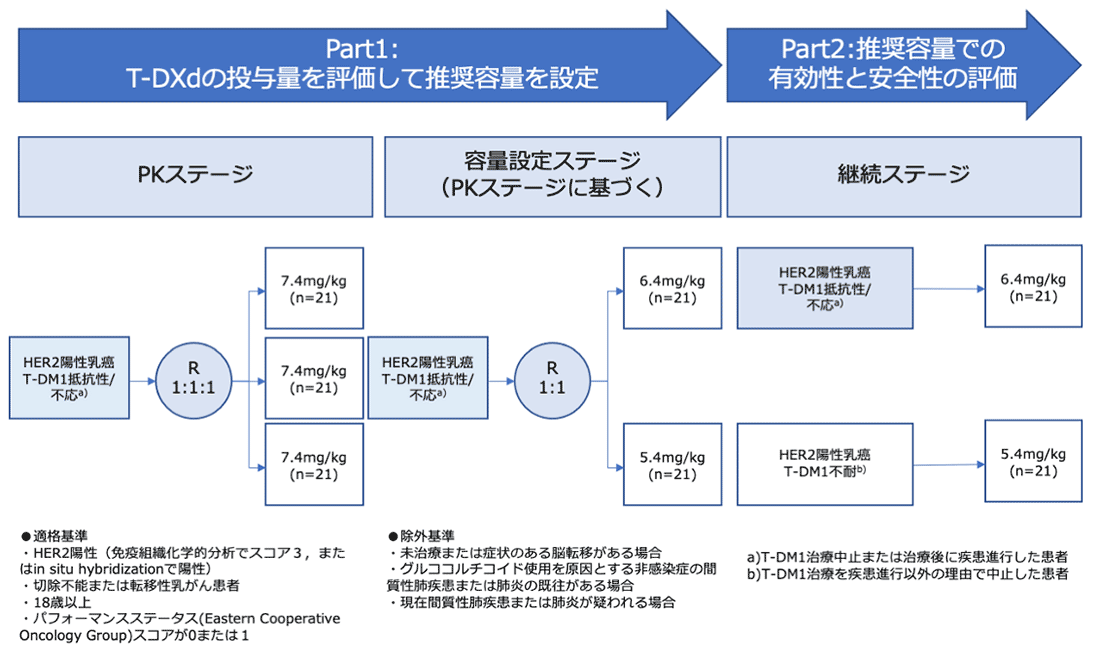
試験結果:
中央値で6レジメンの前治療を受けた184名の患者が、推奨用量 (体重1kgあたり5.4mg)のT-DXdを投与された。前治療のレジメンには全例にT-DM1とT-mab、PERが65.8%、他の抗HER2薬が54.3%含まれていた。
1.主要評価項目: 独立効果判定機関での評価による奏効割合(RECIST Ver.1.1)
奏功率は60.9%(95%CI 53.4~68.0 (95% CI, 53.4 to 68.0)で、このうち、6.0%が完全奏効 (complete response:CR)、54.9%が部分奏効 (partial response:PR) であった。また、1.6%が病勢進行(Progressive Disease:PD)し、1.1%が評価不能であった。T-DXd投与前後の両方のデータが得られた患者のほとんどにおいて、下のFigureのように腫瘍サイズが縮小していた。
2.副次評価項目:
①奏効期間、病勢制御割合(奏効割合+安定割合(Stable Disease:SD))、臨床的有用率(6か月以上のSD+病勢制御割合)、無増悪生存期間(PFS)、安全性
11.1ヶ月の観察期間中央値(範囲、0.7~19.9)で、奏効期間の中央値は14.8カ月(95%CI、13.8~16.9)、PFSの中央値は16.4カ月(95%CI、12.7~未到達)であった。病勢制御割合は97.3% (95% CI, 93.8 to 99.1)、臨床的有用率は76.1% (95% CI, 69.3 to 82.1)であった。
試験期間中に57.1%の患者でグレード3以上の有害事象が発生し、好中球数の減少(20.7%)、貧血(8.7%)、および吐き気(7.6%)が多く認められた。また、独立中央機関判定で13.6%(25人)の患者に間質性肺炎を認めた(グレード1または2が10.9%、グレード3 または4、0.5%、およびグレード5、2.2%)。
この試験では、HER2陽性切除不能・転移再発乳がんにおいて既にT-mabやT-DM1、PERといった抗HER2薬による前治療を受けた患者に対し、T-DXdが持続的な抗腫瘍活性を示し、全奏効割合は60.9%、無増悪生存期間の中央値は16.4カ月、奏効期間の中央値は14.8カ月と良好な結果を示した。最近行われた抗HER2薬の第3相試験でポジティブとなったものには、margetuximabと化学療法の併用(SOPHIA)およびneratinibと化学療法の併用(NALA)があるが、奏効割合が16~32.8%と本試験よりも低かった。SOPHIA試験では、無増悪生存期間の中央値は、margetuximab投与群で5.8カ月、標準治療群で4.9カ月、NALA試験では、neratinibの6ヵ月間の無増悪生存割合は47%であった。また、三次治療以降でのT-DM1の有効性を明らかにしたTH3RESA試験では、T-DM1群の奏効割合は31%、無増悪生存期間の中央値は、6.2カ月であった。本試験は三次治療以降のHER2陽性乳がんを対象としており、単群第2相試験とは言え、T-DXdは驚異的な成績であった。DESTINY-Breast01は単群試験であり、公表時点での追跡期間はわずか11カ月だが、すでにHER2陽性転移乳がん治療に欠かせない治療の一つとなりつつある。二次治療におけるT-DM1との直接比較(NCT03523585)に加え、三次治療以降での標準治療との比較第3相試験(NCT03529110)が進行中である。また、T-DXdはHER2低発現(IHC<3、ISH陰性)に対しても効果が期待されており、HER2低発現乳がんを対象とした臨床試験(U303)も実施されている。安全性の面においては、T-DXdは間質性肺炎の頻度が比較的高くグレード5も報告されていることから、実臨床での投与の際には、投与開始前及び投与中に臨床症状(呼吸状態、咳及び発熱等の有無)を十分に観察し、定期的に動脈血酸素飽和度(SpO2)検査、胸部X線検査及び胸部CT検査などを考慮し、慎重に経過をみることが重要である。
執筆:国立国際医療研究センター病院 乳腺・腫瘍内科 河村 雪乃 先生
監修:国立国際医療研究センター病院 乳腺・腫瘍内科 下村 昭彦 先生
