| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 切除不能局所進行・転移再発トリプルネガティブ乳癌 | 第3相 | 無増悪生存期間 全生存期間 |
国際 | あり |
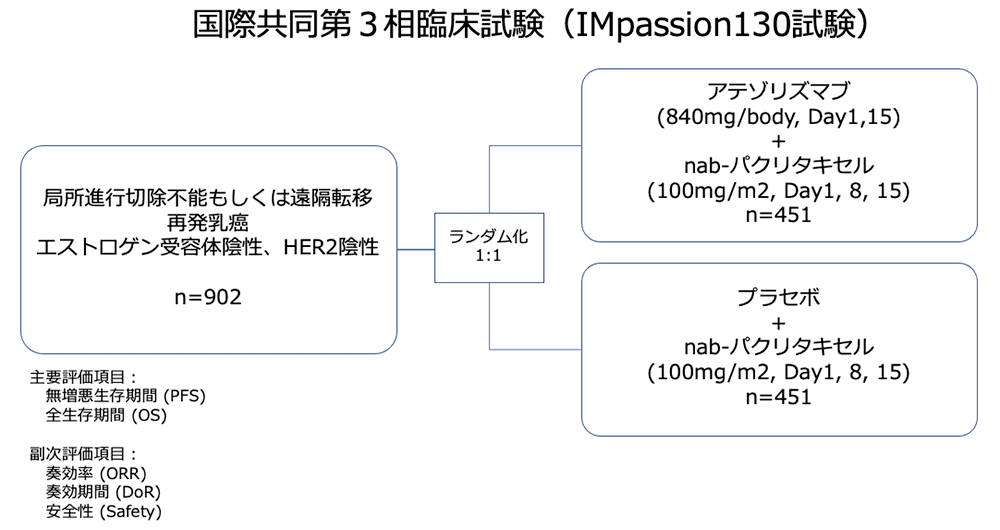
試験名 :IMPassion130
レジメン:アテゾリズマブ+nab-パクリタキセル vs プラセボ+nab-パクリタキセル
登録期間:2015年6月〜2017年5月
背景
腫瘍免疫の作用機序は、がん細胞由来の腫瘍特異的抗原を認識した抗原提示細胞によりT細胞が活性化され、活性型T細胞ががん細胞を排除する。がん細胞は腫瘍免疫から逃避するためにprogrammed death ligand 1(PD-L1)を発現し、活性型T細胞上のPD-1を介してT細胞活性を抑制する。アテゾリズマブ(PD-L1抗体)はPD-L1を介したT細胞抑制を解除することで腫瘍免疫による抗腫瘍効果を認め、転移性尿路上皮がんや非小細胞性肺癌で承認されている。
乳癌でもその有効性が示唆されており、特にトリプルネガティブ乳癌は他のサブタイプと比べて腫瘍組織浸潤リンパ球(tumor―infilatrating lymphocytes;TIL)が多く、アテゾリズマブの効果が高いことが期待されている。
本試験ではアテゾリズマブにnab-パクリタキセルが併用されているが、これは抗がん剤による腫瘍細胞死によって腫瘍抗原放出の増加し腫瘍免疫の促進や、タキサン系抗がん剤のtoll様受容体活性による樹状細胞活性化の可能性、nab-パクリタキセルは前投薬のステロイド製剤が不要であり、免疫に対する影響が少ないと予測され選択された。
シェーマ
主な適格条件
- 18歳以上
- エストロゲン受容体陰性、HER2陰性
- 局所進行切除不能もしくは遠隔転移再発乳癌
- PD-L1発現評価可能な腫瘍組織がある
- タキサン系抗がん剤が使用可能で、転移性乳癌に対してこい癌剤治療及び分子標的薬の使用歴がない
- ECOG PS0もしくは1
主な除外基準
- 無治療の中枢神経系疾患
- 自己免疫性疾患の既往歴
- 免疫チェックポイント阻害薬の使用歴がある
- 4週間以内の弱毒化ワクチンの使用歴
本研究における評価項目
主要評価項目:
- 無増悪生存期間:Progression-free survival(PFS)
- 全生存期間:Overall survival(OS)
各評価項目について、ITT解析及びPD-L1陽性集団における解析を行なっている
副次評価項目:
- 奏効割合:Objective response rate(ORR)
- 奏効期間:Duration of Response (DoR)
- 安全性:Safety
各治療群における各薬剤の投与量および方法
アテゾリズマブ併用群 (1サイクル:28日)
アテゾリズマブ (840mg/body, Day1,15)+nab-パクリタキセル (100mg/m2, Day1, 8, 15)
プラセボ群 (1サイクル:28日)
プラセボ+nab-パクリタキセル (100mg/m2, Day1, 8, 15)
試験結果:
2015年7月~2017年5月までに902例が登録および1:1割り付けされた (ITT集団)。なお、PD-L1集団については、アテゾリズマブ併用群で185例、プラセボ群で184例が割付されている (PD-L1集団)。データカットオフは、2018年4月17日であり、観察期間中央値は12.9ヶ月である (データカットオフ時点における)各集団のイベント数は以下の通り。
ITT集団:アテゾリズマブ併用群N=358(79.4%)、プラセボ群N=378(83.8%)
PD-L1陽性集団:アテゾリズマブ併用群N=138(74.6%)、プラセボ群N=157(85.3%)
- 主要評価項目:
主要評価項目のうち、無増悪生存期間 (PFS)については、ITT集団、PD-L1陽性集団ともにアテゾリズマブ併用群で統計学的有意に延長した。特にPD-L1陽性集団で、アテゾリズマブのより高い上乗せ効果が確認された。
一方、全生存期間 (OS)については、第1回中間解析時点において、ITT集団おけるアテゾリズマブ併用群の統計学的有意な延長は、確認されなかった。
| PFS | アテゾリズマブ+nab-パクリタキセル | プラセボ+nab-パクリタキセル |
|---|---|---|
| ITT集団 | 7.2ヶ月 | 5.5ヶ月 |
| HR=0.80, 95% CI: 0.69-0.92、p=0.002 | ||
| PD-L1陽性集団 | 7.5ヶ月 | 5.0ヶ月 |
| HR=0.62, 95% CI: 0.49-0.78、p<0.001 | ||
| OS (第1回中間解析) | アテゾリズマブ+nab-パクリタキセル | プラセボ+nab-パクリタキセル |
|---|---|---|
| ITT集団 | 21.3ヶ月 | 17.6ヶ月 |
| HR=0.84, 95% CI: 0.69-1.02、p=0.08 | ||
| PD-L1陽性集団 | 25.0ヶ月 | 15.5ヶ月 |
| HR=0.62, 95% CI: 0.45-0.86 | ||
- 副次評価項目:
奏効割合ITT集団における奏効割合 (ORR)は、アテゾリズマブ併用群で統計学的有意に良好であった。完全奏効割合 (CR rate)は、アテゾリズマブ併用群で7.1%、プラセボ群で1.6%と差を認めた。
PD-L1陽性集団においてもアテゾリズマブ併用群で統計学的有意に良好であり、CE rateはアテゾリズマブ併用群で10.3%、プラセボ群で1.1%と差を認めた。
奏効期間中央値についても、ITT集団でアテゾリズマブ併用群で7.4ヶ月 (95% CI: 6.9 – 9.0)、プラセボ群で5.6ヶ月 (95% CI: 5.5 -6.9), [HR=0.78, 95% CI: 0.63-0.98]であった。
PD-L1陽性集団:アテゾリズマブ併用群の中央値8.5ヶ月(95% CI: 7.3 – 9.7)、対照群の中央値5.5ヶ月(95% CI: 3.7 – 7.1), [HR=0.60, 95% CI: 0.43-0.86]であった。
| ITT集団 | PD-L1集団 | |||
|---|---|---|---|---|
| アテゾリズマブ+ nab-パクリタキセル n=450 |
プラセボ+ nab-パクリタキセル n=449 |
アテゾリズマブ+ nab-パクリタキセル n=185 |
プラセボ+ nab-パクリタキセル n=183 |
|
| ORR (%) Odds ratio |
56.0 (51.3 - 60.6) |
45.9 (41.2 - 50.6) |
58.9 (51.5–66.1) |
42.6 (35.4–50.1) |
| 1.52 (1.16 – 1.97) p=0.002 | 1.96 (1.29 – 2.98) p=0.002 | |||
| CR (%) | 7.1 (4.9 - 9.9) |
1.6 (0.6 - 3.2) |
10.3 (6.3–15.6) |
1.1 (0.1–3.9) |
| PR (%) | 48.9 (44.2 - 53.6) |
44.3 (22.5 - 30.8) |
48.6 (41.3–56.1) |
41.5 (34.3–49.0) |
| SD (%) | 25.1 (21.1 - 29.4) |
26.5 (22.5 - 30.8) |
20.5 (15.0–27.1) |
26.8 (20.5–33.8) |
| PD (%) | 15.3 (12.1 - 19.0) |
23.2 (19.3 - 37.3) |
16.8 (11.7–22.9) |
25.1 (19.0–32.1) |
| NE | 3.6 | 4.5 | 3.8 | 5.5 |
安全性について
アテゾリズマブ併用群の99.3%、プラセボ群の97.9%に何らかの有害事象を認めた。
各副作用の発生頻度に大きな差はなく、もっとも多い副作用は脱毛症で、全グレードの発生率は約57%であった。
その他、嘔気、咳嗽、末梢神経障害、好中球現象などが認められたが、特にグレード3以上の末梢神経障害はアテゾリズマブの上乗せにより2.7%から5.5%と増加した。
免疫関連の副作用の頻度はアテゾリズマブ併用群で57.3%、プラセボ群で41.8%認めた。グレード3以上の免疫関連の副作用の頻度はアテゾリズマブ併用群7.5%、プラセボ群4.3%であった。
特に甲状腺機能低下症の発生率はアテゾリズマブ併用群で17.3%、プラセボ群で4.3%とアテゾリズマブの上乗せにより頻度が増えたが、グレードは1もしくは2で、治療中止には至らなかった。
しかし間質性肺炎の発生率には差を認め、アテゾリズマブ併用群で3.1%、プラセボ群で0.2%とアテゾリズマブ投与中は間質性肺炎のマネージメントが重要である。
副作用による何かしらの薬剤投与の中断頻度はアテゾリズマブ併用群で15.9%、プラセボ群で8.2%発生し、アテゾリズマブの中断はアテゾリズマブ併用群で6.4%、プラセボ群で1.4%認めた。
副作用による死亡はアテゾリズマブ併用群で3例(自己免疫性肝炎1例、粘膜関連炎1例、敗血症性ショック1例)、プラセボ群で1例(肝機能障害)であった。
ITT集団での全生存期間における有効性は示されなかったものの、ITT集団・PD-L1陽性集団共に全生存期間が延長する傾向は示された。
一方でアテゾリズマブの上乗せによりグレード3以上の重篤な合併症の増加やアテゾリズマブの中止率は増加するものの、nab-パクリタキセルへの影響はなかった。
トリプルネガティブ乳癌は他のサブタイプと比較して予後不良であり、無増悪生存期間の延長が期待できるアテゾリズマブの上乗せは重要な選択肢となる。
本試験の結果を踏まえ、PD-L1陽性局所進行・転移再発トリプルネガティブ乳癌に対してはアテゾリズマブが標準治療となった。
一方で、ほぼ同様の患者を対象としたパクリタキセルとアテゾリズマブの有効性を評価したIMpassio131試験では、パクリタキセルにアテゾリズマブを上乗せしても無増悪生存期間の改善は認められなかった。
両試験の差としてパクリタキセルの前投薬であるデキサメタゾンの影響やパクリタキセルとnab-パクリタキセルの差などが挙げられるが現時点でははっきりしていない。
また、進行・転移再発トリプルネガティブ乳癌に対するもう1つの選択肢にBRCA1/2遺伝子変異陽性時のPARP阻害薬が挙げられる。
PARP阻害薬は生殖細胞系列BRCA1/2遺伝子変異陽性HER2陰性進行・転移再発乳癌に対し医師選択標準化学療法と比較して有意に無増悪生存期間を延長した。
局所進行・転移再発トリプルネガティブ乳癌に薬物療法を行う場合にはPD-L1及びBRCA1/2遺伝学的検査を行った上で薬剤選択することが一般的となるが、PD-L1とBRCA1/2遺伝子変異の両者が陽性となった場合にどちらを優先すべきか比較した試験はない。
選択肢は増えてきているが未だ十分な治療効果が得られないトリプルネガティブ乳癌において最適な薬剤選択を行うために、今後は適切なタイミングでのPD-L1検査、また免疫チェックポイント阻害薬に特異的な副作用のマネジメントが重要になる。
監修:国立国際医療研究センター病院 乳腺・腫瘍内科 下村 昭彦 先生