| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 二次治療 | 第3相 | 無増悪生存期間 全生存期間 |
国際 | なし |
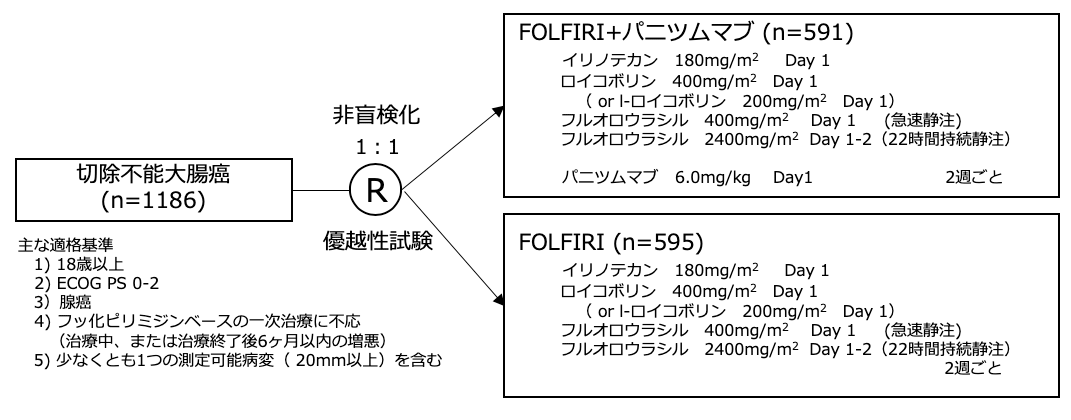
試験名 :20050181試験
レジメン:FOLFIRI vs FOLFIRI+パニツムマブ
登録期間:2006年6月〜2008年3月
背景
KRAS遺伝子変異は、切除不能大腸癌の35-43%に認められる。いくつかの第2相/第3相試験結果をレトロスペクティブに解析したところ、KRAS変異型症例では抗EGFR抗体薬の効果が期待できないことが報告され、完全ヒト抗EGFR抗体薬であるパニツムマブの単剤療法は、欧米では「標準的化学療法に不応となったKRAS野生型切除不能大腸癌」に対する承認となった。
本試験(20050181試験)では、二次治療におけるパニツムマブのFOLFIRIへの上乗せ効果を検証した。当初は遺伝子変異解析は計画されていなかったが、上述した状況を受け、KRAS status別の解析を行うよう計画を変更した。
本試験(20050181試験)では、二次治療におけるパニツムマブのFOLFIRIへの上乗せ効果を検証した。当初は遺伝子変異解析は計画されていなかったが、上述した状況を受け、KRAS status別の解析を行うよう計画を変更した。
シェーマ
統計学的事項
主要評価項目:無増悪生存期間、全生存期間
主要評価項目はKRAS status別の無増悪生存期間(PFS)と全生存期間(OS)である。本試験はKRAS野生型において、FOLFIRI群を対照としてFOLFIRI+パニツムマブのPFSのハザード比が0.67、OSのハザード比が0.724となることを検証する優越性試験として設計され、PFSの検出力90%、α=0.01、OSの検出力85%、α=0.04として、380イベントが必要とされた。
試験結果:
- 2006年6月から2008年3月までに1186例が登録され、591例がFOLFIRI+パニツムマブ群に、595例がFOLFIRI群に割り付けられた。
- そのうち1083例(91%)でKRAS statusが測定可能であり、597例(55%)が野生型、486例(45%)が変異型であった。
- 治療群別、KRAS status別にみて、患者背景に大きな隔たりはなかった。
- 観察期間中央値は下記のとおりであった。
FOLFIRI+パニツムマブ群(KRAS野生型)13.3ヶ月
FOLFIRI群 (KRAS野生型)10.2ヶ月
FOLFIRI+パニツムマブ群(KRAS変異型)10.5ヶ月
FOLFIRI群 (KRAS変異型) 9.5ヶ月
1. KRAS status別の無増悪生存期間(主要評価項目)
| KRAS野生型 | KRAS変異型 | |||||||
|---|---|---|---|---|---|---|---|---|
| n | PFS 中央値 |
95% 信頼区間 |
n | PFS 中央値 |
95% 信頼区間 |
|||
| FOLFIRI+パニツムマブ | 303 | 5.9ヶ月 | 5.5-6.7 | HR 0.73 (0.59-0.90) P=0.004 |
238 | 5.0ヶ月 | 3.8-5.6 | HR 0.85 (0.68-1.06) P=0.14 |
| FOLFIRI | 294 | 3.9ヶ月 | 3.7-5.3 | 248 | 4.9ヶ月 | 3.6-5.6 | ||
2. KRAS status別の全生存期間(主要評価項目)
| KRAS野生型 | KRAS変異型 | |||||||
|---|---|---|---|---|---|---|---|---|
| n | OS 中央値 |
95% 信頼区間 |
n | OS 中央値 |
95% 信頼区間 |
|||
| FOLFIRI+パニツムマブ | 303 | 14.5ヶ月 | 13.0-16.0 | HR 0.85 (0.70-1.04) P=0.12 |
238 | 11.8ヶ月 | 10.4-13.3 | HR 0.94 (0.76-1.15) |
| FOLFIRI | 294 | 12.5ヶ月 | 11.2-14.2 | 248 | 11.1ヶ月 | 10.3-12.4 | ||
3. 後治療
- KRAS野生型症例において後治療に抗EGFR抗体薬を使用したのは、FOLFIRI+パニツムマブ群で10%、FOLFIRI群で31%であった。また治療期間中央値はそれぞれ11.8ヶ月と7.6ヶ月であった。
4. 奏効割合(中央判定)
| KRAS野生型 | KRAS変異型 | |||||||
|---|---|---|---|---|---|---|---|---|
| n* | 奏効割合 | 95% 信頼区間 |
n* | 奏効割合 | 95% 信頼区間 |
|||
| FOLFIRI+パニツムマブ | 297 | 35% (PR 35例) |
30-41 | P<0.0001 | 232 | 13% (PR 13例) |
9-18 | P=1.0 |
| FOLFIRI | 285 | 10% (PR 10例) |
7-14 | 237 | 14% (PR 14例) |
10-19 | ||
* ベースライン時に中央判定で病変が測定可能であった患者のみ
5. Grade 3以上のおもな有害事象 (NCI-CTCAE v.3.0)
| KRAS野生型(n=596) | KRAS変異型(n=483) | |||
|---|---|---|---|---|
| FOLFIRI+パニツムマブ (n=302) |
FOLFIRI (n=294) |
FOLFIRI+パニツムマブ (n=237) |
FOLFIRI (n=246) |
|
| 全有害事象 | 219(73%) | 152(52%) | 151(64%) | 123(50%) |
| 好中球減少症 | 59 (20%) | 68 (23%) | 32 (14%) | 43(17%) |
| 皮膚毒性 | 111 (37%) | 7 (2%) | 75 (32%) | 2 (1%) |
| 下痢 | 41 (14%) | 27 (9%) | 32 (14%) | 26 (11%) |
| 粘膜炎 | 23 (8%) | 8 (3%) | 22 (9%) | 9 (4%) |
| 発熱性好中球減少症 | 6 (2%) | 9 (3%) | 3 (1%) | 7 (3%) |
| インフュージョンリアクション | 2 (<1%) | - | 0 | - |
結語
本試験は、切除不能大腸癌の二次治療における抗EGFR抗体薬の治療効果を、初めてKRAS status別に前向きに解析した大規模臨床試験である。KRAS野生型症例に対するFOLFIRI+パニツムマブ併用療法は認容性も高く、有意な無増悪生存期間の延長が認められた。
執筆:静岡県立静岡がんセンター 消化器内科 レジデント 井上 博登 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生