大腸癌 BASIC
Combination chemotherapy with bevacizumab and S-1 for elderly patients with metastatic colorectal cancer (BASIC trial).
Yoshida M, Muro K, Tsuji A, et al. Eur J Cancer. 2015;51:935-41. [PubMed]
| 対象疾患 |
治療ライン |
研究の相 |
主要評価項目 |
実施地域 |
日本の参加 |
| 大腸癌 |
一次治療 |
第2相 |
無増悪生存期間 |
国内 |
あり |
試験名 :BASIC
レジメン:S-1+Bevacizumab
登録期間:2008年10月〜2010年3月
高齢者では化学療法にともなう血液毒性の頻度が高く、切除不能大腸癌におけるFOLFOX/FOLFIRIなどの併用レジメンの使用には注意が必要である。5-FU+ Bevacizumab(Bev)(AVF780試験)では無増悪生存期間が中央値9.2ヶ月、カペシタビン+Bev(
AVEX試験)では中央値9.1ヶ月と、良好な治療成績と安全性が示されている。また、S-1は単独でも切除不能大腸癌における有効性が示されており、今回の試験(BASIC)では、高齢者を対象にS-1+Bevの有効性・安全性を示すために実施された。
シェーマ
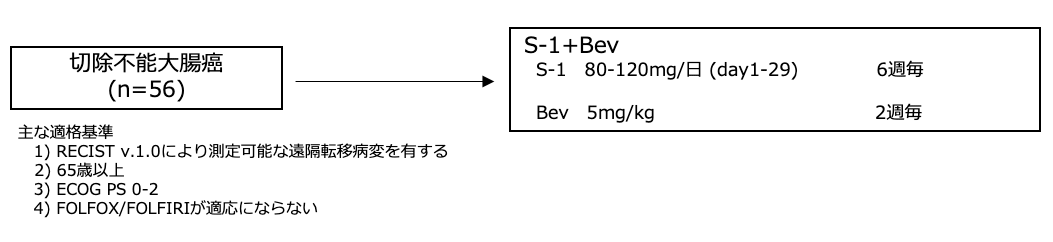
主要評価項目:無増悪生存期間
本試験は主要評価項目を無増悪生存期間(PFS)とした。PFSの期待値を8.5ヶ月、閾値 5ヶ月、検出力80%、片側α=0.05と設定すると、50例の登録が必要とされた。不適格症例を踏まえて55例を必要症例数とした。
試験結果:
- 2008年10月から2010年3月の間に国内の8施設から56例が登録された。観察期間中央値は34.6ヶ月であった。
- 患者背景として、年齢中央値が75歳 (66 -85歳 )、PS 0/1がそれぞれ28例ずつであった。
1. 無増悪生存期間(主要評価項目)
| |
中央値 |
95%信頼区間 |
| S-1+Bev(n=56) |
9.9ヶ月 |
7.9 – 11.0 |
2. 全生存期間
| |
中央値 |
95%信頼区間 |
| S-1+Bev(n=56) |
25.0ヶ月 |
19.4 – 31.6 |
3. 奏効割合
| |
奏効割合(Confirmed) |
| S-1+Bev(n=56) |
43%(CR 1例、PR 23例) |
4. 病勢制御割合
| |
病勢制御割合(Confirmed) |
| S-1+Bev(n=56) |
89%(CR 1例、PR 23例、SD 26例) |
5. 有害事象(CTCAE ver.3.0)
| |
全Grade |
Grade 3以上 |
| 好中球減少症 |
17 (30%) |
4 (7%) |
| 血小板減少症 |
25 (45%) |
2 (4%) |
| 貧血 |
39 (70%) |
1 (2%) |
| 下痢 |
35 (63%) |
5 (9%) |
| 食思不振 |
41 (73%) |
3 (5%) |
| 高血圧 |
20 (36%) |
6 (11%) |
6. Kohne’s index (PS, ALP, 転移臓器個数による予後リスク分類)別の全生存期間
| |
中央値 |
95%信頼区間 |
HR(vs low risk group) |
p値 |
| high risk (n=14) |
14.4ヶ月 |
7.5–25.0 |
4.21 |
<0.001 |
| intermediate risk (n=19) |
28.5ヶ月 |
18.5–32.3 |
1.63 |
0.237 |
| low risk (n=23) |
35.3ヶ月 |
22.3-NR |
1 |
|
S-1+Bevacizumabは高齢者の切除不能大腸癌に対する安全かつ有効な治療法となり得る。
執筆:静岡県立静岡がんセンター 消化器内科 レジデント 井上 博登 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生
