| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 二次治療以降 | 第2相 | 奏効割合 | 国際 | なし |
試験名 :CheckMate-142
レジメン:ニボルマブ
登録期間:2014年3月〜2016年3月
背景
DNAミスマッチ修復機構欠損(dMMR)/高頻度マイクロサテライト不安定性(MSI-H)を有する転移性大腸癌は、大腸癌全体の約5%に認められることが報告されているが、DNAミスマッチ修復機構欠損のない(pMMR)/マイクロサテライト安定性(MSS)の転移性大腸癌と比較し、化学療法による治療効果が乏しく、予後不良であることが報告されている。しかしながら、近年の報告より、dMMR/MSI-H固形がんに対して免疫チェックポイント阻害薬の有効性が報告されている。
CheckMate142試験はdMMR/MSI-H大腸癌に対するニボルマブ(NIVO)単剤療法、及びNIVO+イピリムマブ併用療法の有効性、安全性を検討するマルチコホート第2相試験である。本稿では既治療例に対するNIVO単剤療法コホートでの有効性、安全性、およびバイオマーカー分析を報告する。
CheckMate142試験はdMMR/MSI-H大腸癌に対するニボルマブ(NIVO)単剤療法、及びNIVO+イピリムマブ併用療法の有効性、安全性を検討するマルチコホート第2相試験である。本稿では既治療例に対するNIVO単剤療法コホートでの有効性、安全性、およびバイオマーカー分析を報告する。
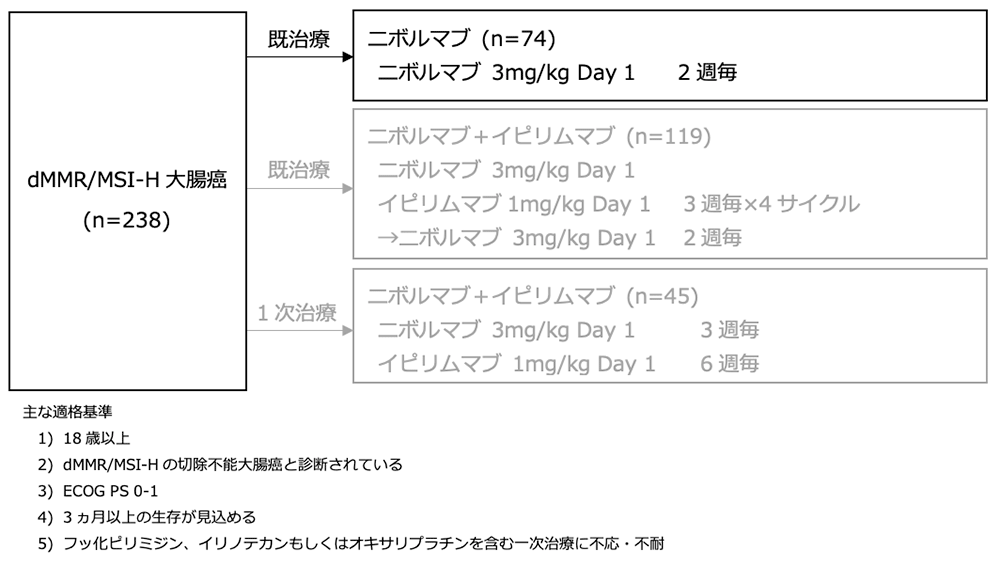
シェーマ
統計学的事項
主要評価項目:主治医判定による奏効割合
副次的評価項目:盲検下独立中央判定による客観的奏効割合
探索的評価項目:安全性、主治医判定/盲検下独立中央判定による無増悪生存期間、全生存期間、バイオマーカー発現による有効性、QOLの変化
本試験はSimonの二段階デザインに基づいて設定された。第1ステージで中央判定にてMSI-Hと診断された19例中、奏効例(PR/CR)が7例以上の場合に、中央判定にてMSI-Hと診断された29例を追加し、第2ステージに進む予定とした(詳細な症例数設定根拠は記載されておらず)。試験結果:
- 2014年3月から2016年3月までの間に8か国31施設から、施設判定でdMMR/MSI-Hと診断された転移性大腸癌症例 74例が第1/第2ステージに登録された。
- データカットオフは2017年1月3日で、観察期間中央値は12.0ヶ月(四分位範囲 8.6-18.0)であった。
- 患者背景:施設判定でdMMR/MSI-Hと診断された74例中、57例(77%)が65歳未満であり、40例(54%)が3つ以上の前治療歴を有していた。また、29例(39%)はBRAF/KRAS 野生型であり、12例(16%)はBRAF 変異型であった。53例(72%)が中央判定でMSI-Hと判定され、14例(19%)はNon-MSI-H、7例(9%)が検体不良のため判定不能であった。
- データカットオフ時点で36例(49%)が試験治療を継続中であった。治療中止理由は病勢進行 27例(36%)、治療関連有害事象 6例(8%)、治療に関連しない有害事象/最良の治療効果/患者希望/同意撤回/その他がそれぞれ1例(1%)ずつであった。
- NIVO投与回数の中央値は22回であった(四分位範囲 6-29)。
1. 主治医判定(主要評価項目)/盲検化独立中央判定による客観的奏効割合
| N(%) | 施設判定でdMMR/MSI-H (n=74) | 中央判定でdMMR/MSI-H (n=53) | ||
|---|---|---|---|---|
| 画像評価 | 主治医判定 | 盲検化独立中央判定 | 主治医判定 | 盲検化独立中央判定 |
| 客観的奏効割合 (95%信頼区間) |
23 (31.1) (20.8-42.9) |
24 (32) (22-44) |
19 (36) (23-50) |
19 (36) (23-50) |
| 最良効果 CR PR SD PD Not determined |
0 23 (31) 28 (38) 19 (26) 4 (5) |
2 (3) 22 (30) 25 (34) 21 (28) 4 (5) |
0 19 (36) 20 (37) 11 (21) 3 (6) |
1 (2) 18 (34) 19 (36) 12 (23) 3 (6) |
| 12週以上の病勢制御割合 (95%信頼区間) |
51 (69) (57-79) |
47 (64) (52-74) |
39 (74) (60-85) |
37 (70) (56-82) |
- 第1ステージ(中央判定でMSI-Hと診断された最初の19例)において、7例の奏効例が得られたため、第2ステージの登録が開始された。
- 主治医判定と盲検化独立中央判定による奏効例の一致率は88%であった。
2. 中央判定でNon-MSI-H/判定不能となった症例の客観的奏効割合
| N(%) | 中央判定でNon-MSI-H (n=14) | 中央判定で判定不能 (n=7) | ||
|---|---|---|---|---|
| 画像評価 | 主治医判定 | 盲検化独立中央判定 | 主治医判定 | 盲検化独立中央判定 |
| 客観的奏効割合 (95%信頼区間) |
3 (21) (5-51) |
3 (21) (5-51) |
1 (14) (0.4-58) |
2 (29) (4-71) |
| 最良効果 CR PR SD PD Not determined |
0 3 (21) 5 (36) 5 (36) 1 (7) |
0 3 (21) 3 (21) 7 (50) 1 (7) |
0 1 (14) 3 (43) 3 (43) 0 |
1 (14) 1 (14) 3 (43) 2 (29) 0 |
| 12週以上の病勢制御割合 (95%信頼区間) |
8 (57) (29-82) |
5 (36) (13-65) |
4 (57) (18-90) |
5 (71) (29-96) |
3. バイオマーカーによる客観的奏効割合 (主治医判定)
| N (%) | 症例数 | 客観的奏効割合 | 12週以上の病勢制御割合 |
|---|---|---|---|
| 腫瘍部のPD-L1発現 ≧1% <1% |
21 47 |
6 (29) 13 (28) |
11 (52) 35 (75) |
| 免疫細胞部のPD-L1発現 まれ 中等度 多数 |
24 21 23 |
5 (21) 5 (24) 9 (39) |
14 (58) 17 (81) 15 (65) |
| 遺伝子変異状況 BRAF/KRAS 野生型 BRAF 変異型 KRAS 変異型 |
29 12 26 |
12 (41) 3 (25) 7 (27) |
23 (79) 9 (75) 16 (62) |
| リンチ症候群 あり なし |
27 28 |
9 (33) 8 (29) |
19 (70) 21 (75) |
4. 奏効までの期間(主治医判定)
| 中央値 | 四分位範囲 | ||
|---|---|---|---|
| 施設判定でdMMR/MSI-H | N=74 | 2.8ヶ月 | 1.4-3.2 |
5. 奏効期間 (主治医判定)
| 中央値 | 四分位範囲 | ||
|---|---|---|---|
| 施設判定でdMMR/MSI-H | N=23 | 未到達 | NE |
- 解析時点で奏効例は全例、生存しており、8例が12ヶ月以上の奏効を持続していた。
6. 無増悪生存期間 (主治医判定)
| イベント数 | 中央値(95%信頼区間) | 12ヶ月無増悪生存割合(95%信頼区間) | |
|---|---|---|---|
| N=74 | 36 | 14.3ヶ月(4.30-NE) | 50%(38-61) |
7. 全生存期間
| イベント数 | 中央値(95%信頼区間) | 12ヶ月生存割合(95%信頼区間) | |
|---|---|---|---|
| N=74 | 23 | 未到達(18.0-NE) | 73%(62-82) |
8. CEAの変動 (事後分析)
- 治療開始時から7週目(43日目)までのCEA変化は奏効例(CR/PR)と12週以上のSD症例で近似していた。
- 12週以上の病勢制御が得られた症例は、12週未満のSDもしくはPD症例と比較して大幅なCEA低下が認められた。
| 奏効例(CR/PR) | 12週以上のSD | 12週以上の病勢制御 | 12週未満のSDもしくはPD | |
|---|---|---|---|---|
| 症例数 | 19 | 16 | 35 | 7 |
| 平均変化(%) [標準偏差] |
-31.1 [62.1] |
-18.3 [67.8] |
-25.3 [64.1] |
36.6 [80.9] |
| 中央値(%) [範囲] |
-56.4 [-84.9-157.4] |
-45.5 [-88.9-142.7] |
-45.8 [-88.9-157.4] |
-0.23 [-53.3-154.4] |
9. 患者報告アウトカム (PRO)
- PRO質問票の完了割合は91週までの期間で68-100%であった。
- 試験期間中、50%以上の症例はEORTC QLQ-C30における機能、症状および全般的な健康状態/QOLに関して、臨床的に意味のある悪化をさせずに維持された。
- EORTC QLQ-C30では、13週の時点で機能(精神的/役割/社会的)、症状(疲労/疼痛/不眠/食欲不振/便秘/下痢)および全般的なQOLにおいて、臨床的にも意味のある改善を認め、その内のいくつかは37週を超えても維持された。身体機能、悪心/嘔吐、または呼吸困難の有意義な改善は観察されず、認知機能の悪化が67週目に観察された。
- EQ-5Dでは治療開始時に12%(セルフケア)から57%(疼痛)の症例で健康上の問題を報告していた。これら健康上の問題を報告した症例において、少なくとも13週の時点で、全ての項目(可動性、セルフケア、通常の活動、疼痛/不快感、不安/うつ病)で10%以上の著明な改善を示した。
- 治療開始時のEQ-5D Visual analogue scale(VAS)スコアは51.1(標準偏差 33.7)であり、19週間治療を継続した症例では68.0-87.7の平均VASスコアに改善を示した。
10. 治療関連有害事象 (CTCAE v4.0)
治療関連有害事象Grade 1-2Grade 3Grade 4
| N=74 | N (%) | ||
|---|---|---|---|
| 全治療関連有害事象 | 36 (49) | 13 (18) | 2 (3) |
| 疲労 | 16 (22) | 1 (1) | 0 |
| 下痢 | 15 (20) | 1 (1) | 0 |
| そう痒症 | 10 (14) | 0 | 0 |
| 皮疹 | 8 (11) | 0 | 0 |
| 悪心 | 7 (10) | 0 | 0 |
| 甲状腺機能低下症 | 7 (10) | 0 | 0 |
| 無力症 | 5 (7) | 0 | 0 |
| AST増加 | 5 (7) | 0 | 0 |
| 関節痛 | 4 (5) | 0 | 0 |
| 発熱 | 4 (5) | 0 | 0 |
| 皮膚乾燥 | 4 (5) | 0 | 0 |
| 斑状丘疹状皮疹 | 4 (5) | 1 (1) | 0 |
| ALT増加 | 3 (4) | 1 (1) | 0 |
| リパーゼ増加 | 3 (4) | 4 (5) | 2 (3) |
| 血清アミラーゼ増加 | 2 (3) | 2 (3) | 0 |
- 全ての原因による有害事象は73例(99%)に認められた[Grade 1-2:29例(39%)、Grade 3:30例(41%)、Grade 4:10例(14%)]。4例(5%)が治療とは関連しない有害事象(突然死:1例、心疾患:1例、病勢進行:2例)で死亡した。
- 治療関連有害事象は52例(70%)に認められた。複数の症例に生じた唯一のGrade 3以上の治療関連有害事象はリパーゼ増加6例(8%)と血清アミラーゼ増加2例(3%)であった。
- 5例(7%)がそれぞれALT増加、大腸炎、十二指腸潰瘍、急性腎不全、及び口腔粘膜炎により、治療中止に至った。
- 治療関連の重篤な有害事象は9例(12%)に発生し、副腎機能不全、ALT増加、大腸炎、下痢、胃炎、口腔粘膜炎、急性腎不全、疼痛、関節炎(各1例)が含まれており、全てGrade 3-4であった。
- 1例の原因不明の突然死も報告された。この症例はGrade 3の大腸炎に対する治療としてステロイドの漸減中で最後の投与から10日後に死亡した。死因は剖検にて特定されず、治療関連有害事象とは判断されなかった。
- 20例(27%)が病勢進行により死亡し、3例(4%)が原因不明で死亡した。12例(16%)は最終投与から100日以内の死亡であり、その内、5例(7%)は30日以内の死亡であった。
- 治療関連死亡は認めなかった。
結語
NIVOは前治療歴を有するdMMR/MSI-H切除不能大腸癌に持続的な奏効と病勢制御を示し、新たな治療選択肢の一つとなり得る。
執筆:北海道大学病院 消化器内科 特任助教 原田 一顕 先生
監修:関西医科大学附属病院 がんセンター 学長特命准教授 佐竹 悠良 先生
監修:関西医科大学附属病院 がんセンター 学長特命准教授 佐竹 悠良 先生