| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 三次治療 | 第2相 | 奏効割合 | 国際 | なし |
試験名 :CRICKET
レジメン:イリノテカン+セツキシマブ
登録期間:2015年1月〜2017年6月
背景
現在、抗EGFR抗体薬の獲得耐性は、RAS 遺伝子野生型の腫瘍内にRAS 遺伝子変異型のサブクローンが出現することが一因であると考えられている。しかし、抗EGFR抗体薬開始後に新たに獲得した変異型サブクローンの増殖なのか、それとも抗EGFR抗体薬開始前から存在するものの検出できなかった変異型サブクローンの選択的増殖なのかは不明である。変異型サブクローンの選択的増殖の仮説に基づけば、抗EGFR抗体薬投与後、感受性のある野生型クローンは減少するものの、抵抗性の変異型クローンが次第に増殖することで不応となる。
抗EGFR抗体薬リチャレンジの有効性が期待できる根拠は、獲得体制取得後の抗EGFR抗体薬を含まない治療中に、残存している感受性の野生型クローンが再増殖することであると考えられている。また、獲得耐性後に認められたRAS 遺伝子変異型サブクローンは、抗EGFR抗体薬中止後に経時的に減少する(半減期4.4か月)ことが報告されている2)。
本試験は、イリノテカン(IRI)と抗EGFR抗体薬を含む一次治療に奏効した後に増悪し、ベバシズマブを含む二次治療を受けた患者に対する、IRIと抗EGFR抗体薬のリチャレンジの有効性を評価することを目的とした第2相試験である。リキッドバイオプシーとしての血液サンプルをリチャレンジ実施前に収集し、ctDNA RAS 遺伝子変異の有無が効果予測因子となるかを解析することで、この治療戦略のベネフィットがあるかを検討した。
シェーマ
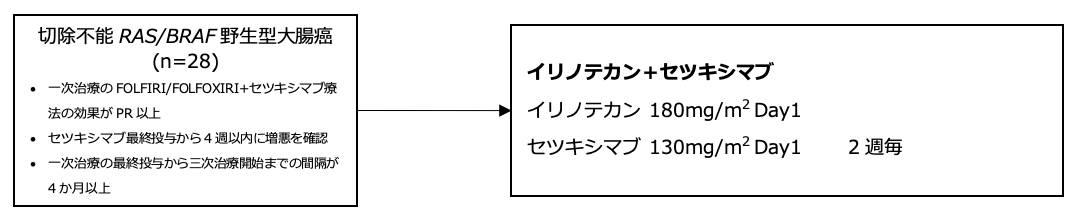
主な適格基準
- 組織学的に腺癌であることが確認されているRAS /BRAF 遺伝子野生型切除不能大腸癌
- 年齢:18歳以上
- ECOG PS 0-2
- RECIST ver1.1で測定可能病変を有する
- 一次治療でFOLFIRIまたはFOLFOXIRIとセツキシマブの併用療法が実施され、部分奏効(PR)以上が得られている
- 一次治療のセツキシマブの最終投与から4週以内に増悪が確認されている
- 二次治療でFOLFOXIRI、FOLFOXまたはXELOXとベバシズマブの併用療法が行われ、一次治療の最終投与日から三次治療の開始まで4か月以上の間隔があいている
統計学的事項
主要評価項目:奏効割合
閾値奏効割合を5%、期待奏効割合を20%とし、片側有意水準5%、検出力80%とし、目標症例数は27例と算出された。試験結果:
- 2015年1月から2017年6月の間に、イタリア国内9施設から28例が登録された。
- 年齢中央値は69歳(range, 45-79歳)、18人(64%)がECOG PS 0であった。21人(75%)が多臓器転移を有する一方、5人(18%)は肝限局転移であった。切除不能大腸癌の診断から試験登録までの期間中央値は24.4か月であった。
- データカットオフの2018年3月1日時点で、フォローアップ期間中央値は15.4か月(四分位範囲4.35-13.25)であった。
1. 奏効割合(主要評価項目)・病勢制御割合
| 症例数 | CR | PR | SD | PD | NE | 奏効割合 (95%信頼区間) |
病勢制御割合 (95%信頼区間) |
|---|---|---|---|---|---|---|---|
| 28 | 0 (0%) |
6* (21%) |
9 (32%) |
10 (36%) |
3 (11%) |
21% (10-40) |
54% (36-70) |
*PRの6例中4例で以降のCTで確定を得ている
- 28例から初回治療効果判定の画像評価前に臨床的病勢進行を認めた3例(11%)を除いた25例中13例(52%)で画像評価における腫瘍縮小を認めた。
2. 病勢制御期間
| 症例数 | 中央値 | 95%信頼区間 |
|---|---|---|
| 28 | 9.9週 | 8.1-23.1週 |
3. 無増悪生存期間
| 症例数 | 中央値 | 95%信頼区間 |
|---|---|---|
| 28 | 3.4か月 | 1.9-3.8か月 |
4. 全生存期間
| 症例数 | 中央値 | 95%信頼区間 |
|---|---|---|
| 28 | 9.8か月 | 5.2-13.10か月 |
5. 投与状況
治療サイクル中央値:4.5サイクル
相対用量強度
| 薬剤 | IRI | CET |
|---|---|---|
| 平均相対用量強度 | 87.3% | 94.8% |
6. 有害事象(Grade3-4)
| 有害事象 | Grade3-4(%) |
|---|---|
| 下痢 | 5(18) |
| 皮膚毒性 | 4(14) |
| 好中球数減少 | 4(14) |
| 手足症候群 | 2(7) |
| 発熱性好中球減少症 | 1(4) |
| 口内炎 | 1(4) |
| 悪心 | 1(4) |
| 結膜炎 | 1(4) |
| 低マグネシウム血症 | 1(4) |
- 有害事象による治療中止は認めなかった
7. プロトコール治療開始直前のctDNA RAS 遺伝子型別の有効性解析
リチャレンジ開始直前に採取したctDNAの解析では、RAS 遺伝子変異を25例中12例(48%)に認めた。BRAF 遺伝子変異やPIK3CA 遺伝子変異は認めなかった。
ctDNA RAS 遺伝子野生例は、ctDNA RAS 遺伝子変異例に比較してPFSの有意な改善(PFS中央値4.0か月vs. 1.9か月、HR=0.44、95% CI: 0.18-0.98、p=0.03)を認め、OSは有意ではないものの良好な傾向であった(OS中央値12.5か月vs. 5.2か月、HR=0.58、95% CI: 0.22-1.52、p=0.24)。また、奏効割合はctDNA RAS 遺伝子野生例において38%(5/13例)、ctDNA RAS 遺伝子変異例において8%(1/12例)であった。
ctDNA RAS 遺伝子ステータスがリチャレンジの効果予測因子である可能性が示唆された。
監修:愛知県がんセンター病院 薬物療法部 医長 舛石 俊樹 先生