| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 一次治療 | 第3相 | 無増悪生存期間 | 国際 | なし |
試験名 :CRYSTAL
レジメン:FOLFIRI+セツキシマブvs FOLFIRI
登録期間:2004年7月〜2005年11月
背景
初回治療を対象にFOLFIRI(フルオロウラシル+ロイコボリン+イリノテカン)に対するセツキシマブ(CET)の上乗せ効果を検証する第3相試験(CRYSTAL試験)において、全体集団では、全生存期間においては有意差がなかったものの(FOLFIRI+CET vs. FOLFIRI=19.9か月 vs. 18.6か月, HR=0.93, 95%CI:0.81-1.07, p=0.31)、主要評価項目である無増悪生存期間は、CET併用群が有意に良好であった(各々8.9か月 vs. 8.0か月, HR=0.85, 95%CI:0.72-0.99, p=0.048)。その後、KRAS 変異有無別の後方視的な解析が行われ、KRAS 野生型では無増悪生存期間(各々中央値9.9か月 vs. 8.7か月, HR=0.68, 95%CI:0.50-0.94, p=0.02)、全生存期間(各々中央値24.9か月 vs. 21.0か月, HR=0.84, 95%CI:0.64-1.11)、奏効割合(各々59% vs. 43%, オッズ比1.91)ともにCETの上乗せ効果が認められたものの、KRAS 変異型では無増悪生存期間(各々中央値7.6か月 vs. 8.1か月, HR=1.07, 95%CI:0.71-1.61, p=0.75)、全生存期間(各々中央値17.5か月 vs. 17.7か月, HR=1.03, 95%CI:0.74-1.44)、奏効割合(各々36% vs. 40%, オッズ比0.80)いずれもCETの上乗せ効果は示せなかった1)。本検討では、CRYSTAL試験の患者を対象に、RAS (KRAS /NRAS )変異の有無*とCET併用の効果との関連について後方視的に検討した。
*本検討では腫瘍組織を用いたRAS 変異検査としてBEAMing法を用いた。
シェーマ
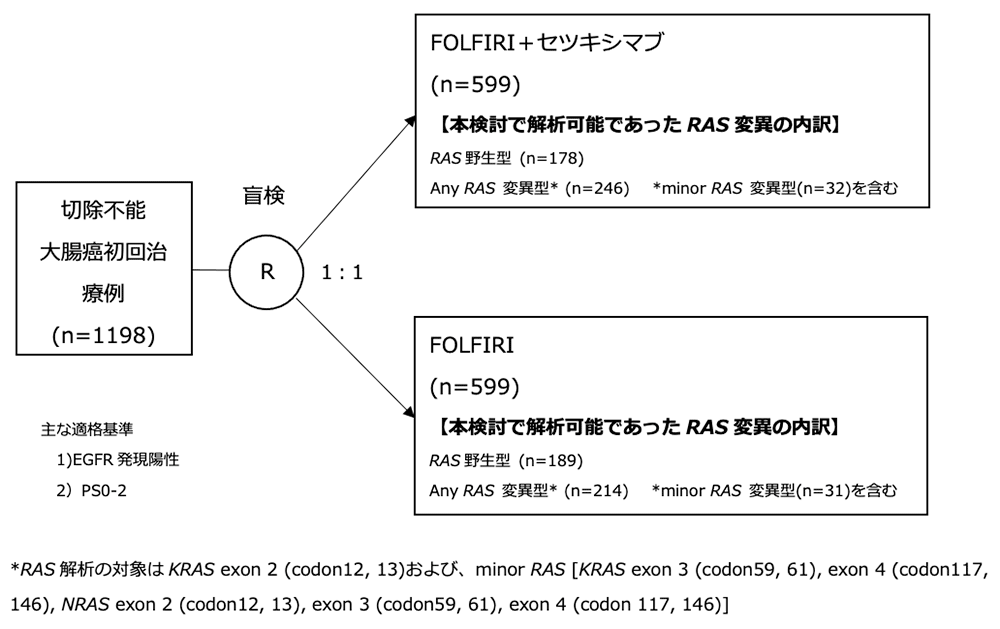
統計学的事項
主要評価項目:無増悪生存期間
RAS 変異の有無と生存との関連について後方視的に検討した。試験結果:
1. 無増悪生存期間(主要評価項目)
| RAS 野生型 | minor RAS 変異型 | Any RAS 変異型 | ||||
|---|---|---|---|---|---|---|
| FOLFIRI+CET | FOLFIRI | FOLFIRI+CET | FOLFIRI | FOLFIRI+CET | FOLFIRI | |
| N | 178 | 189 | 32 | 31 | 246 | 214 |
| 無増悪生存期間中央値(月) | 11.4 | 8.4 | 7.2 | 6.9 | 7.4 | 7.5 |
| HR (95%CI) | 0.56 (0.41-0.76) | 0.81 (0.39-1.67) | 1.10 (0.85-1.42) | |||
| p | <0.001 | 0.56 | 0.47 | |||
- 無増悪生存期間はRAS 野生型においてCET併用群で有意な延長が認められたが、minor RAS 変異型、およびAny RAS 変異型においては、CETの上乗せ効果は認めなかった。
2. 全生存期間
| RAS 野生型 | minor RAS 変異型 | Any RAS 変異型 | ||||
|---|---|---|---|---|---|---|
| FOLFIRI+CET | FOLFIRI | FOLFIRI+CET | FOLFIRI | FOLFIRI+CET | FOLFIRI | |
| N | 178 | 189 | 32 | 31 | 246 | 214 |
| 全生存期間中央値(月) | 28.4 | 20.2 | 18.2 | 20.7 | 16.4 | 17.7 |
| HR (95%CI) | 0.69 (0.54-0.88) | 1.22 (0.69-2.16) | 1.05 (0.86-1.28) | |||
| p | 0.0024 | 0.50 | 0.64 | |||
- 全生存期間においてもRAS 野生型においてCET併用群で有意な延長が認められたが、minor RAS 変異型、およびAny RAS 変異型においては、CETの上乗せ効果は認めなかった。
3. 奏効割合
| RAS 野生型 | minor RAS 変異型 | Any RAS 変異型 | ||||
|---|---|---|---|---|---|---|
| FOLFIRI+CET | FOLFIRI | FOLFIRI+CET | FOLFIRI | FOLFIRI+CET | FOLFIRI | |
| N | 178 | 189 | 32 | 31 | 246 | 214 |
| 奏効割合(%) | 66.3 | 38.6 | 34.4 | 35.5 | 31.7 | 36.0 |
| OR (95%CI) | 3.11 (2.03-4.78) | 1.02 (0.33-3.15) | 0.85 (0.58-1.25) | |||
| p | <0.001 | 0.97 | 0.40 | |||
- 奏効割合においてもRAS 野生型においてCET併用群で有意な上昇が認められたが、minor RAS 変異型、およびAny RAS 変異型においては、CETの上乗せ効果は認めなかった。
4. 有害事象(Grade3-4)
| RAS 野生型 | minor RAS 変異型 | Any RAS 変異型 | ||||
|---|---|---|---|---|---|---|
| FOLFIRI+CET | FOLFIRI | FOLFIRI+CET | FOLFIRI | FOLFIRI+CET | FOLFIRI | |
| N | 178 | 189 | 32 | 31 | 246 | 214 |
| 全有害事象 (%) | 144 (80.9) | 110 (58.2) | 25 (78.1) | 21 (67.7) | 189 (76.8) | 133 (62.1) |
| 好中球減少症 (%) | 55 (30.9) | 38 (20.1) | 9 (28.1) | 8 (25.8) | 62 (25.2) | 58 (27.1) |
| 下痢 (%) | 26 (14.6) | 18 (9.5) | 3 (9.4) | 2 (6.5) | 30 (12.2) | 22 (10.3) |
| 皮疹 (%) | 16 (9.0) | 0 | 3 (9.4) | 0 | 19 (7.7) | 0 |
| 白血球減少症 (%) | 15 (8.4) | 7 (3.7) | 0 | 3 (9.7) | 12 (4.9) | 13 (6.1) |
| 疲労 (%) | 12 (6.7) | 9 (4.8) | 0 | 2 (6.5) | 16 (6.5) | 5 (2.3) |
| 深部静脈血栓症 (%) | 11 (6.2) | 1 (0.5) | 0 | 1 (3.2) | 2 (0.8) | 9 (4.2) |
| ざ瘡様皮疹 (%) | 9 (5.1) | 0 | 2 (6.3) | 0 | 14 (5.7) | 0 |
| インフュージョンリアクション (%) | 4 (2.2) | 0 | 0 | 0 | 7 (2.8) | 0 |
- Grade3-4の有害事象に関して、RAS 変異による頻度の違いは認められなかった。
結語
CRYSTAL試験の探索的RAS 解析により、RAS 野生型切除不能大腸癌に対してFOLFIRI+CET療法を行う有用性が示された。KRAS 野生型からminor RAS 変異型を除外することによりCETの上乗せ効果がより強くなる傾向が確認された。抗EGFR抗体薬併用療法を導入する際には、KRAS エクソン2(コドン12, 13)変異のみではなく、RAS (KRAS /NRAS )変異の有無を考慮する必要がある。
関連論文
1) Van Cutsem E, Kohne CH, Hitre E, et al. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med 2009;360:1408-17. [Pubmed]
執筆:静岡県立静岡がんセンター 消化器内科 副医長 白数 洋充 先生
監修:愛知県がんセンター病院 薬物療法部 医長 坂東 英明 先生
監修:愛知県がんセンター病院 薬物療法部 医長 坂東 英明 先生