| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 二次治療 | 第3相 | 全生存期間 | アメリカ・南アフリカ | なし |
試験名 :E3200
レジメン:FOLFOX4+Bev vs FOLFOX4 vs Bev
登録期間:2001年11月〜2003年4月
背景
抗VEGF-A抗体薬であるBevacizumab(Bev)は、切除不能大腸癌の一次治療においてフッ化ピリミジン系の化学療法への併用効果が証明されている。本試験(E3200)は前治療歴のある症例に対して、オキサリプラチン(OX)を含んだ化学療法へのBevの併用効果を検証するために実施された。
シェーマ
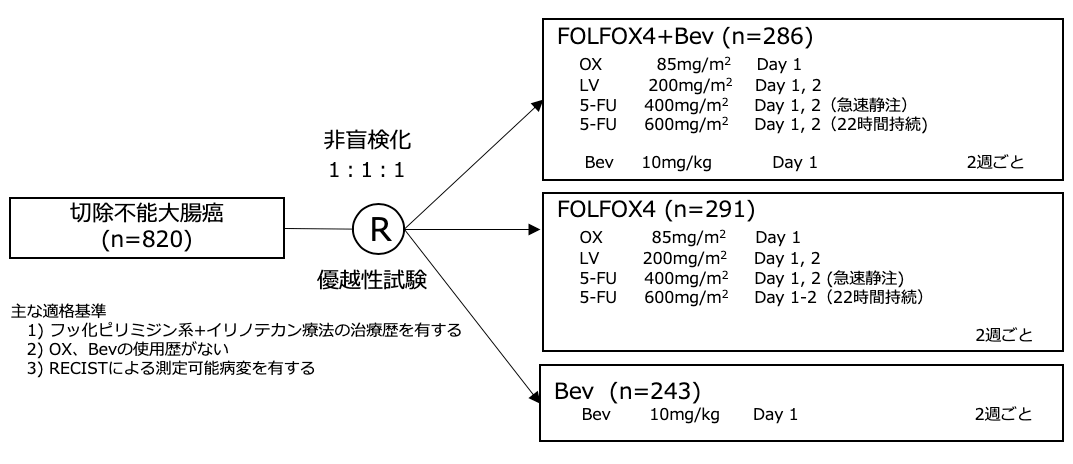
統計学的事項
主要評価項目:全生存期間
本試験は主要評価項目を全生存期間(OS)とした。当初、OSが7ヶ月から10.5ヶ月に50%延長することを期待して検出力90%として設計された。しかし症例登録が想定を上回っていたため、検出力を95%に変更して最終的に880例が必要とされた。試験結果:
- 2003年2月の中間解析において、Bev単独群は化学療法を含む群に対する劣性が示唆されたため割付中止となった。
- 結果、2001年11月から2003年4月までの間に、アメリカと南アフリカの221施設から829例が登録された。そのうち不適格であった9例を除外した820例をITT集団とした(FOLFOX4+Bev群 286例、FOLFOX4群 291例、Bev群 243例)。
- 各群の患者背景に偏りはなかった。
1. 全生存期間(主要評価項目)
| 中央値 |  HR 0.75, p=0.0011 HR 0.75, p=0.0011 |
|
| FOLFOX4+Bev (n=286) | 12.9ヶ月 | |
| FOLFOX4(n=291) | 10.8ヶ月 | |
| Bev (n=243) | 10.2ヶ月 |
2. 無増悪生存期間
| 中央値 |  HR 0.61, p<0.0001 HR 0.61, p<0.0001 |
|
| FOLFOX4+Bev (n=280) | 7.3ヶ月 | |
| FOLFOX4(n=279) | 4.7ヶ月 | |
| Bev (n=237) | 2.7ヶ月 |
3. 奏効割合(主治医判定)
| 奏効割合 |  p<0.0001 p<0.0001 |
|
| FOLFOX4+Bev | 22.7% | |
| FOLFOX4 | 8.6% | |
| Bev | 3.3% |
4. Grade 3以上の有害事象 (CTCAE ver.2)
| FOLFOX4+Bev(n=287) | FOLFOX4(n=285) | Bev(n=234) | ||||
|---|---|---|---|---|---|---|
| Grade 3 | Grade 4 | Grade 3 | Grade 4 | Grade 3 | Grade 4 | |
| 高血圧 | 5.2% | 1.0% | 1.4% | 0.4% | 7.3% | 0% |
| 出血 | 3.1% | 0.3% | 0.4% | 0% | 2.1% | 0% |
| 嘔吐 | 8.7% | 1.4% | 2.8% | 0.4% | 4.7% | 0% |
| 蛋白尿 | 0.7% | 0% | 0% | 0% | 0% | 0% |
| 神経障害 | 16% | 0.3% | 8.8% | 0.4% | 0.4% | 0.4% |
| 血栓塞栓症 | 3.1% | 0.3% | 1.1% | 1.4% | 0% | 0.4% |
- 出血の多くは消化管出血であった。
- 脳出血による死亡を2例に認めた (Bevを含む群で各1例)。
- 消化管穿孔を6例に認めた (Bevを含む群で各3例)。
結語
切除不能大腸癌の二次治療において、オキサリプラチン併用療法にBevacizumabを併用することで生存期間が延長することが証明された。
執筆:静岡県立静岡がんセンター 消化器内科 レジデント 井上 博登 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生