| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 二次治療 | 第3相 | PFS | 国内 | あり |
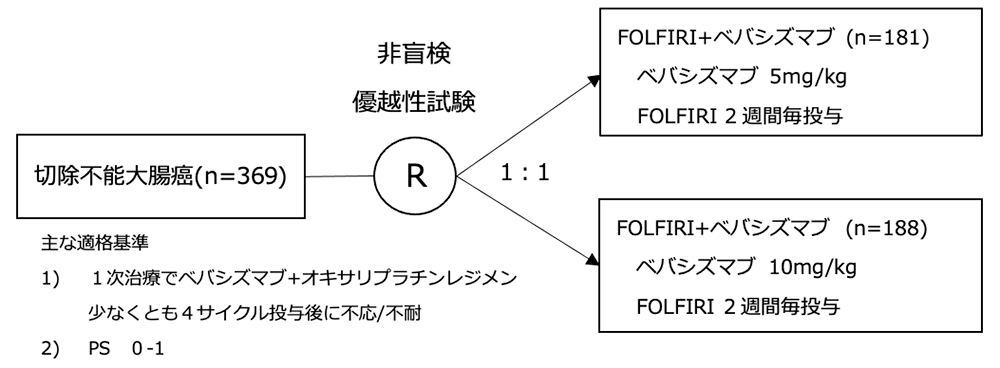
試験名 :EAGLE
レジメン:FOLFIRI+ベバシズマブ(5mg/kg) vs FOLFIRI+ベバシズマブ(10mg/kg)
登録期間:2009年9月〜2012年1月
背景
切除不能大腸癌に対してはFOLFOX療法(5-FU/LV+オキサリプラチン)やFOLFIRI療法(5-FU/LV+イリノテカン)に血管新生阻害剤であるベバシズマブ(BEV)や抗EGFR抗体を加えた化学療法が標準治療として確立している。二次治療を対象としたE3200試験1)ではBEVは10mg/kgで投与されており、同用量で生存期間を延長した。その一方で一次治療の臨床試験2,3)におけるBEVの用量は5mg/kgとなっており、最適なBEVの用量は明らかでない。さらにBEVの抗腫瘍効果は用量との関連が示唆されている。今回、一次治療でオキサリプラチンベース+BEV併用療法に不応不耐となった症例に対する、二次治療のFOLFIRIにおけるBEV併用の10mg/kgと5mg/kgとの有効性と安全性を比較検証するための第3相試験(EAGLE試験)を実施した。
シェーマ
統計学的事項
主要評価項目:無増悪生存期間
無増悪生存期間中央値がBEV 5mg/kgの5.0ヶ月からBEV 10mg/kgで7.0ヶ月に延長(リスクが30%減少)することを、両側α=0.05、検出力90%で検証するために(登録期間2年、フォローアップ期間1年)、330イベント、358例の登録が必要となり、逸脱を考慮し370例の症例登録を予定した。試験結果:
- 2009年9月~2012年12月の期間で国内100施設より387例が登録され、このうち369例がFAS解析の対象となり、365例が安全性解析の対象となった。
- データカットオフは2013年9月28日、観察期間中央値は394日(344―432日)であった。
- 患者背景には大きな隔たりは認めなかった。
1. 無増悪生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.95 (95%CI 0.75-1.21) p=0.676 |
|
| BEV 5mg/kg群 | 6.1 ヶ月 | 5.3-7.0 | |
| BEV 10mg/kg群 | 6.4 ヶ月 | 5.6-7.4 |
2. 治療成功期間
| 中央値 | 95%信頼区間 | HR 1.01 (95%CI 0.81-1.25) p=0.967 |
|
| BEV 5mg/kg群 | 5.2 ヶ月 | 4.5-5.8 | |
| BEV 10mg/kg群 | 5.2 ヶ月 | 4.5-5.7 |
3. 全生存期間
| 中央値 | 95%信頼区間 | HR 1.08 (95%CI 0.75-1.57) p=0.667 |
|
| BEV 5mg/kg群 | 16.3 ヶ月 | 14.1-21.2 | |
| BEV 10mg/kg群 | 17.0 ヶ月 | 14.6-19.1 |
- 無増悪生存期間、治療成功期間、全生存期間のいずれも両群間で有意な差は認められなかった。
4. 有害事象
| BEV 5mg/kg群 (n=180) | BEV 10mg/kg群 (n=185) | |||||||
|---|---|---|---|---|---|---|---|---|
| All grades | Grade ≥3 | All grades | Grade ≥3 | |||||
| N | % | N | % | N | % | N | % | |
| 白血球減少 | 121 | 67 | 27 | 15 | 114 | 62 | 32 | 17 |
| 好中球減少 | 120 | 67 | 87 | 48 | 118 | 64 | 77 | 42 |
| 貧血 | 119 | 66 | 4 | 2 | 118 | 64 | 7 | 4 |
| 血小板数減少 | 62 | 34 | 1 | 0.6 | 66 | 36 | 2 | 1 |
| 疲労 | 105 | 58 | 15 | 8 | 117 | 63 | 21 | 11 |
| 食思不振 | 112 | 62 | 11 | 6 | 119 | 64 | 10 | 5 |
| 悪心 | 91 | 51 | 9 | 5 | 97 | 52 | 8 | 4 |
| 嘔吐 | 35 | 19 | 5 | 3 | 48 | 26 | 7 | 4 |
| 下痢 | 71 | 39 | 6 | 3 | 80 | 43 | 3 | 2 |
| 口内炎 | 89 | 49 | 5 | 3 | 88 | 48 | 7 | 4 |
| 脱毛 | 71 | 39 | 0 | 0 | 81 | 44 | 0 | 0 |
| 高血圧 | 26 | 14 | 2 | 1 | 36 | 20 | 3 | 2 |
| 尿蛋白 | 71 | 39 | 2 | 1 | 69 | 37 | 1 | 0.5 |
| 消化管出血 | 9 | 5 | 1 | 0.6 | 6 | 3 | 0 | 0 |
| 鼻出血 | 29 | 16 | 0 | 0 | 41 | 22 | 1 | 0.5 |
| 動脈血栓症 | 1 | 0.6 | 1 | 0.6 | 2 | 1 | 2 | 1 |
| 静脈血栓症 | 2 | 1 | 2 | 1 | 3 | 2 | 2 | 1 |
| 消化管穿孔 | 1 | 0.6 | 1 | 0.6 | 1 | 0.5 | 1 | 0.5 |
- 高血圧や尿蛋白、消化管出血なども含め、有害事象に差は認められなかった。
結語
二次治療でのFOLFIRIとの併用においてBEVを5mg/kgから10mg/kgへ増量しても無増悪生存期間は延長されなかった。二次治療でBEVを継続投与する際には5mg/kgが適切な用量と考えられる。
関連論文
1) Giantonio BJ, Catalano PJ, Meropol NJ et al. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol 2007; 25: 1539–1544. [Pubmed]
2) Hurwitz H, Fehrenbacher L, Novotny W et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004; 350: 2335–2342. [Pubmed]
3) Saltz LB, Clarke S, Díaz-Rubio E et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 2008; 26: 2013–2019. [Pubmed]
執筆:静岡県立静岡がんセンター 消化器内科 レジデント 古田 光寛 先生
監修:愛知県がんセンター病院 薬物療法部 医長 坂東 英明 先生
監修:愛知県がんセンター病院 薬物療法部 医長 坂東 英明 先生