| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 一次治療 | 第3相 | 無増悪生存期間 | 国際 | なし |
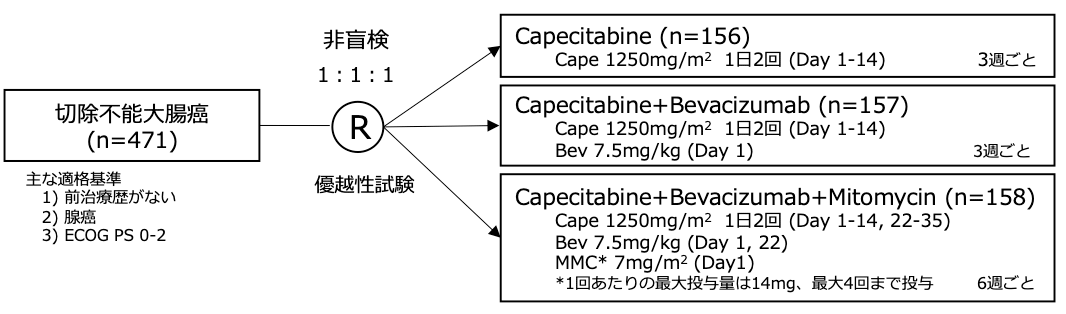
試験名 :AGITG MAX
レジメン:Cape vs Cape+Bev vs Cape+Bev+MMC
登録期間:2005年7月〜2007年6月
背景
ベバシズマブ(Bev)はVEGF-Aを阻害するヒト化モノクローナル抗体であり、化学療法との併用で有効性が証明されている。最も頻度の高い有害事象は尿蛋白や高血圧であり、通常、QOLには影響しにくい。
マイトマイシン(MMC)はフッ化ピリミジンとの併用で奏効割合と無増悪生存期間(PFS)の改善効果が報告されており、フッ化ピリミジンと併用しても血小板減少やまれに認められた溶血性尿毒症症候群(HUS)以外の毒性は増加しなかった。
これらよりdoubletレジメン不適な患者を対象としたフッ化ピリミジン単剤療法に対するBevの上乗せ効果、さらにはMMCの上乗せ効果を検証することを目的として第3相試験であるAGITG MAX試験が行われた。
シェーマ
統計学的事項
主要評価項目:無増悪生存期間
本試験の主要評価項目はPFSであり、カペシタビン(Cape)とCape+Bevとの比較、CapeとCape+Bev+MMCとの比較を行った。PFSは少なくとも2.5ヶ月延長すると見込み(5.5ヶ月 → 8ヶ月)、登録期間3年、フォローアップ期間12ヶ月、両側α=2.5%、検出力80%と設定し450例の登録が必要とされた。試験結果:
- 2005年7月〜2007年6月の期間に36施設から471例が登録され、15例は不適格であり、3例が試験治療を受けることが出来なかった。
- QOL解析は431例で行われた。
- 3群の患者背景に偏りはなかった。
- データカットオフは2009年2月27日であり、フォローアップ期間中央値は30.8ヶ月であった。
1. 無増悪生存期間(主要評価項目)
| 中央値 | 95% CI | HR | 95%信頼区間 | P値 | |
|---|---|---|---|---|---|
| Cape(n=156) | 5.7ヶ月 | 5.4-6.2 | Reference | ||
| Cape+Bev(n=157) | 8.5ヶ月 | 7.3-9.2 | 0.63 | 0.50-0.79 | <0.001 |
| Cape+Bev+MMC(n=158) | 8.4ヶ月 | 7.5-9.0 | 0.59 | 0.47-0.75 | <0.001 |
2. 奏効割合
| 奏効割合 | P値 | |
|---|---|---|
| Cape(n=142) | 30.3%(CR 1例、PR 42例) | Reference |
| Cape+Bev(n=147) | 38.1%(CR 3例、PR 53例) | 0.16 |
| Cape+Bev+MMC(n=146) | 45.9%(CR 3例、PR 64例) | 0.006 |
3. 全生存期間
| 中央値 | |
|---|---|
| Cape(n=156) | 18.9ヶ月 |
| Cape+Bev(n=157) | 18.9ヶ月 |
| Cape+Bev+MMC(n=158) | 16.4ヶ月 |
多変量解析では一次治療のレジメンの違いは予後に影響していなかった。
4. 有害事象(NCI-CTCAE ver.3.0)
| Cape(n=156) | Cape+Bev(n=157) | Cape+Bev+MMC(n=158) | ||||
|---|---|---|---|---|---|---|
| All grade | Grade 3-5 | All grade | Grade 3-5 | All grade | Grade 3-5 | |
| Cape関連 | ||||||
| 下痢 | 62% | 11% | 65% | 17% | 71% | 16% |
| 手足症候群 | 65% | 16% | 77% | 26% | 78% | 28% |
| 口内炎 | 26% | 2.6% | 48% | 1.3% | 53% | 3.8% |
| 嘔吐 | 31% | 5.1% | 38% | 5.1% | 40% | 4.4% |
| 悪心 | 54% | 5.8% | 67% | 5.1% | 70% | 5.7% |
| 疲労 | 74% | 9.6% | 78% | 9.6% | 85% | 13% |
| 発熱性好中球減少 | 1.9% | 1.9% | 2.5% | 2.5% | 1.9% | 1.9% |
| 感染(好中球減少を伴わない) | 29% | 8.3% | 36% | 10% | 36% | 11% |
| 好中球減少(感染を伴わない) | 10% | 1.3% | 12% | 0 | 21% | 1.9% |
| ビリルビン高値 | 7.7% | 2.6% | 6.4% | 0.6% | 7.0% | 1.3% |
| Bev関連 | ||||||
| 尿蛋白 | 12% | 0.6% | 31% | 3.2% | 47% | 6.3% |
| 高血圧 | 12% | 0.6% | 29% | 3.8% | 25% | 6.3% |
| 静脈血栓症/塞栓症 | 10% | 7.1% | 10% | 8.9% | 11% | 10% |
| 動脈血栓塞栓症 | 0 | 0 | 4.5% | 3.2% | 4.4% | 4.4% |
| 消化管穿孔 | 0.6% | 0.6% | 1.9% | 1.9% | 0.6% | 0.6% |
| 出血 | 12% | 2.6% | 12% | 1.3% | 20% | 5.1% |
| MMC関連 | ||||||
| 血小板減少 | 9.6% | 0 | 15% | 0 | 44% | 4.4% |
| HUS | 0 | 0 | 0 | 0 | 1.3% | 1.3% |
5. QOL
baseline、治療開始3週間後、6週間後、3週間後からPDまでの期間それぞれで、QOLは各群で同程度であった。
6. サブグループ解析
Cape+BevおよびCape+Bev+MMCを統合した症例群とCape群との間でサブグループ解析が行われた。サブグループ解析では、各サブグループともにCape+Bev/Cape+Bev+MMC群は同様の治療効果を示したが、特に肝転移のみの症例(interaction HR 0.36 v 0.71; interaction P=0.02)、もしくは転移臓器個数1つの症例(interaction HR 0.25 v 0.66; interaction P=0.03)で良好であった。
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生