| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 一次治療 | 第3相試験 | 全生存期間 | 英国、アイルランド | なし |
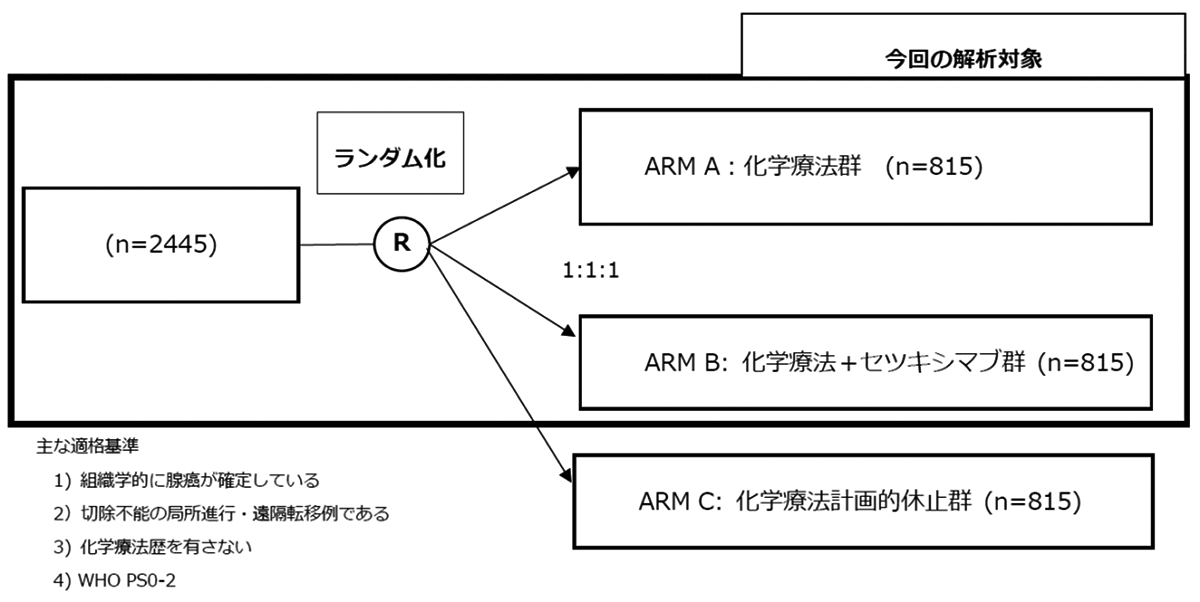
試験名 :MRC COIN trial
レジメン:化学療法(FOLFOX [フルオロウラシル+オキサリプラチン]療法もしくはCapeOX [カペシタビン+オキサリプラチン]療法)+セツキシマブ
登録期間:2005年3月9日〜2008年5月9日
背景
Epidermal growth factor receptor(EGFR) は最も注目される治療標的であり、肺がんにおいてはゲフィチニブやエルロチ二ブといったEGFR tyrosine kinase inhibitorsがEGFR変異を持つ症例において有用であることが示された。大腸がんにおいてEGFR変異はほぼ認められないが、細胞外ドメインと結合するEGFRに対するモノクローナル抗体の有用性が示されている。しかしその有用性はKRAS変異の認められない症例に限られている1)-3)。KRASは、受容体から核へのシグナル伝達経路(RAS–RAF–MAPK経路)の重要な低分子Gタンパク質であるKRASをコードしており、変異によりKRASがGTPの結合した活性型に留まるため、EGFRの細胞外ドメインに抗体が結合しても下流へのシグナル伝達が遮断できなくなる。
今回、進行大腸がんの一次治療において、化学療法(FOLFOX [フルオロウラシル+オキサリプラチン]療法もしくはCapeOX [カペシタビン+オキサリプラチン]療法のいずれかを主治医が決定)に抗EGFR抗体であるセツキシマブ(CET)併用の有効性を検証する第3相試験(Medical Research Council (MRC) COIN trial)が行われ、その後バイオマーカーとしてKRASが確立されたことによりKRAS野生型症例が主たる解析対象となり、さらにBRAF、NRAS変異との関連性についても解析が行われた。本COIN試験では、化学療法の計画的休止の生存期間に与える影響も評価され、別論文で報告されている。
今回、進行大腸がんの一次治療において、化学療法(FOLFOX [フルオロウラシル+オキサリプラチン]療法もしくはCapeOX [カペシタビン+オキサリプラチン]療法のいずれかを主治医が決定)に抗EGFR抗体であるセツキシマブ(CET)併用の有効性を検証する第3相試験(Medical Research Council (MRC) COIN trial)が行われ、その後バイオマーカーとしてKRASが確立されたことによりKRAS野生型症例が主たる解析対象となり、さらにBRAF、NRAS変異との関連性についても解析が行われた。本COIN試験では、化学療法の計画的休止の生存期間に与える影響も評価され、別論文で報告されている。
シェーマ
統計学的事項
主要評価項目:全生存期間
主要評価項目は全生存期間であり、当初ARM AとARM B全体集団の2年生存率において6.4%の上乗せ(20%→26.4%,Hazard ratio(HR): 0.828)を90%の検出力で検出できるようにするため、ARM AとARM B併せて1614例が必要とされた。その後ARM AとARM Bの主たる解析対象がKRAS野生型となり、主解析はKRAS野生型症例における全生存期間のイベントが511起きた時点で行われるように変更された(検出力87%、片側αが0.05の設定でHRが0.76)。また副次的解析として、KRAS/NRAS/BRAF野生型群、KRAS変異群、KRAS/NRAS/BRAFのいずれかに変異を認める群、および試験全体の4群における治療毎の全生存期間も解析された。試験結果:
- 1630例がARM AとARM Bの比較に割り付けられた。そのうち1316例(81%)がKRAS,BRAFおよびNRASの測定が可能であった。KRAS変異は565例(43%)、BRAF変異は102例(8%)およびNRAS変異が50例(4%)で認められた。
- 患者背景
| ALL | KRAS 野生型 | KRAS変異型 | ||||
|---|---|---|---|---|---|---|
| ARM A (n=815) | ARM B (n=815) | ARM A (n=367) | ARM B (n=362) | ARM A (n=268) | ARM B (n=297) | |
| 男性 | 64% | 67% | 67% | 70% | 63% | 65% |
| 年齢 | 63(56-69) | 63(58-70) | 63(56-69) | 64(59-70) | 63(56-69) | 64(58-70) |
| PS0-1 | 92% | 92% | 93% | 94% | 92% | 90% |
| PS2 | 8% | 8% | 7% | 6% | 9% | 9% |
| 直腸癌 | 30% | 32% | 28% | 33% | 34% | 31% |
| 結腸癌 | 56% | 54% | 57% | 54% | 54% | 55% |
| 原発切除あり | 55% | 52% | 59% | 52% | 59% | 58% |
| 同時性転移 | 68% | 70% | 64% | 68% | 67% | 71% |
| 異時性転移 | 31% | 29% | 34% | 31% | 31% | 29% |
| 転移なし | 1% | 1% | 1% | 1% | 1% | 0% |
| 肝限局性転移 | 21% | 24% | 25% | 24% | 16% | 25% |
| 転移臓器数≧2 | 24% | 24% | 23% | 24% | 32% | 23% |
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR (95% CI)p= | ||
|---|---|---|---|---|
| KRAS野生型 | 化学療法+CET | 17ヶ月 | (9.4-30.1) | 1.04(0.87-1.23) p=0.67 |
| 化学療法 | 17.9ヶ月 | (10.3-29.2) | ||
| KRAS変異型 | 化学療法+CET | 13.6ヶ月 | (8.0-26.1) | 0.98(0.81-1.17) p=0.80 |
| 化学療法 | 14.8ヶ月 | (9.5-22.8) | ||
| BRAF変異かつ KRAS野生型 |
化学療法+CET | 7.2ヶ月 | Not evaluated | 1.18(0.76-1.81) p=0.46 |
| 化学療法 | 10.0ヶ月 | |||
| KRAS/NRAS及び BRAF野生型 |
化学療法+CET | 19.9ヶ月 | Not evaluated | 1.02(0.83-1.24) p=0.86 |
| 化学療法 | 20.1ヶ月 |
- 化学療法+CET群は全生存期間において、KRAS野生型、KRAS変異型、BRAF変異型、KRAS/NRAS/BRAF野生型群のいずれにおいても生存期間の有意な改善を示すことが出来なかった。
2. 無増悪生存期間(KRAS野生型)
| 中央値 | 95%信頼区間 | HR:0.96 (95% CI: 0.82-1.12) p=0.60 |
|
| 化学療法+CET | 8.6ヶ月 | 5.1-13.8 | |
| 化学療法 | 8.6ヶ月 | 5.0-12.5 |
- KRAS野生型群において無増悪生存期間もCETの上乗せによる改善は認めなかった。
3. 奏効割合(KRAS野生型)
| 奏効割合 | HR :1.35 (95% CI:1.00-1.82) p=0.049 |
|
| 化学療法+CET | 64% | |
| 化学療法 | 57% |
- KRAS野生型群における奏効割合は化学療法+CET群で有意に良好であった。
4. 遺伝子変異別の全生存期間
| 患者数 | 中央値 | 95%信頼区間 | |
|---|---|---|---|
| KRAS,NRAS,BRAFのいずれかに変異あり | 706 | 13.6ヶ月 | 7.9-21.3 |
| KRAS,NRAS,BRAFのいずれかも変異なし | 581 | 20.1ヶ月 | 11.5-31.7 |
| BRAF変異あり | 102 | 8.8ヶ月 | 4.5-16.1 |
| NRAS変異あり | 38 | 13.8ヶ月 | 8.2-24.1 |
| KRAS変異あり | 548 | 14.4ヶ月 | 8.5-24.0 |
- 遺伝子変異における全生存期間の比較ではBRAF変異症例は不良で、KRAS/NRAS/BRAF野生型症例で良好な傾向を認めた。
5. Grade3以上の有害事象
| 化学療法 ARM A (N=815) | 化学療法+CET ARM B (N=815) | ARM AとBの比較 | ||||||
|---|---|---|---|---|---|---|---|---|
| FOLFOX | CapeOX | p | FOLFOX | CapeOX | p | FOLFOX | CapeOX | |
| 好中球減少 | 31% | 4% | 0.0001 | 31% | 2% | 0.0001 | 0.90 | 0.17 |
| 貧血 | 2% | 1% | 0.36 | 7% | 3% | 0.0058 | 0.0033 | 0.038 |
| 血小板減少 | 3% | 2% | 0.70 | 2% | 3% | 0.68 | 0.99 | 0.99 |
| 嘔気 | 5% | 7% | 0.21 | 6% | 9% | 0.14 | 0.58 | 0.21 |
| 下痢 | 11% | 15% | 0.10 | 20% | 26% | 0.030 | 0.0055 | 0.0001 |
| 手足症候群 | 3% | 5% | 0.13 | 6% | 13% | 0.0064 | 0.026 | 0.0001 |
| 皮疹 | 0% | <1% | 0.99 | 20% | 20% | 0.92 | 0.0001 | 0.0001 |
| 爪変形 | 0% | 0% | - | 2% | 2% | 0.94 | 0.014 | 0.00045 |
| 口内炎 | 5% | 1% | 0.0004 | 10% | 3% | 0.00021 | 0.023 | 0.0023 |
| 嗜眠 | 18% | 18% | 0.99 | 29% | 24% | 0.13 | 0.0033 | 0.023 |
| 低MG血症 | 0 | 0 | - | 6% | 3% | 0.059 | 0.0001 | 0.0001 |
- 化学療法群と比較し、化学療法+CET群では貧血、手足症候群、皮疹、爪変形、口内炎、嗜眠および低マグネシウム血症が有意に増加した。FOLFOX療法とCapeOX療法を比較すると、化学療法群では好中球減少および口内炎をFOLFOX療法で有意に多く認めた。化学療法+CET群においては好中球減少、貧血、口内炎および低マグネシウム血症はFOLFOX群で有意に多く、下痢と手足症候群は有意にCapeOX群で多く認めた。
6. KRAS/NRAS/BRAF野生型群における無増悪生存期間に影響する因子の解析
| 因子 | 患者数 | HR(95% CI) | p | |
|---|---|---|---|---|
| 性別 | 男 | 408 | 0.87(0.71-1.07) | 0.38 |
| 女 | 173 | 1.02(0.74-1.41) | ||
| 年齢 | 65歳以上 | 338 | 1.00(0.80-1.26) | 0.22 |
| 65歳未満 | 243 | 0.81(0.62-1.06) | ||
| 原発巣 | 結腸 | 301 | 0.84(0.66-1.07) | 0.68 |
| 直腸 | 196 | 0.96(0.71-1.29) | ||
| 転移臓器数 | 0-1 | 230 | 0.73(0.55-0.97) | 0.036 |
| 2以上 | 351 | 1.07(0.86-1.33) | ||
| 肝転移限局 | No | 428 | 1.02(0.84-1.25) | 0.044 |
| Yes | 153 | 0.68(0.48-0.97) | ||
| 同時性転移 | No | 201 | 1.01(0.75-1.35) | 0.12 |
| Yes | 374 | 0.90(0.72-1.11) | ||
| フッ化ピリミジン系薬剤 | カペシタビン | 391 | 1.02(0.82-1.26) | 0.10 |
| フルオロウラシル | 190 | 0.72(0.53-0.98) | ||
| 白血球数 | 10000/L未満 | 428 | 0.88(0.72-1.08) | 0.41 |
| 10000/L以上 | 153 | 1.05(0.75-1.46) | ||
- 探索的にKRAS/NRAS/BRAF野生型群の無増悪生存期間に影響する因子の解析が行われ、転移臓器数1以下・肝転移限局症例において化学療法+CET群の治療効果は良好であった。
結語
本試験では進行大腸がん一次治療において、オキサリプラチンベースのレジメンに対してCET併用による治療効果の上乗せは示されなかった。KRAS野生型進行大腸がんにおいてCETの奏効割合に対する上乗せを認めたものの、無増悪生存期間や全生存期間の改善は認めなかった。
関連論文
1) Lièvre A, Bachet JB, Le Corre D, et al. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res 2006; 66: 3992–95.[Pubmed]
2) Karapetis CS, Khambata-Ford S, Jonker DJ, et al. K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med 2008; 359: 1757–65. [Pubmed]
3) Amado RG, Wolf M, Peeters M, et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol 2008; 26: 1626–34. [Pubmed]
執筆:神戸市立医療センター中央市民病院 腫瘍内科 医長 松本 俊彦 先生
監修:愛知県がんセンター病院 薬物療法部 医長 坂東 英明 先生
監修:愛知県がんセンター病院 薬物療法部 医長 坂東 英明 先生