| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| HER2 遺伝子増幅を有する切除不能大腸癌 | 二次治療以降 | 第2a相 | 奏効割合 | 米国 | なし |
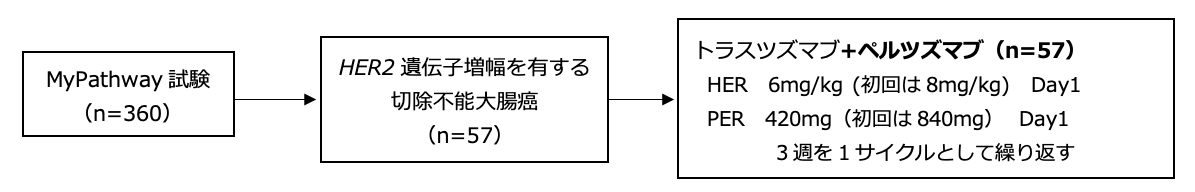
試験名 :MyPathway
レジメン:トラスツズマブ(HER)+ペルツズマブ(PER)
登録期間:2014年10月20日 〜 2017年6月22日(進行中)
背景
- HER2 遺伝子増幅/HER2過剰発現は切除不能腸癌の2-6%と低頻度であり、治療開発が進んでいない。
- HER2は既に他癌種で治療開発が進んでいるが、この10年で大腸癌においても治療標的となりうる遺伝子異常であることが複数の研究で示されてきた。
- 腫瘍移植片やXenograft modelを用いた基礎的検討の結果、HER、PER、ラバチニブ(LPT)など単剤による抗HER2療法はHER2 遺伝子増幅陽性大腸癌に十分な有効性が示されなかったが、PER+LPT、HER+LPTなどの2剤併用による抗HER2療法では抗腫瘍効果が増強することが知られている。
- 実際にHERACLES試験ではHER2陽性KRAS exon 2野生型切除不能大腸癌に対してHER+LPTが客観的奏効割合30%と有望な結果を示した。
- HER+PERは異なるHER2ドメインに作用し乳癌において相乗効果を示すことが知られており、HER2陽性転移性乳癌においては化学療法との併用で一次治療の標準治療となっている。
- MyPathway試験は腫瘍の分子プロファイルに合わせて分子標的薬(HER+PER、ベムラフェニブ(JAN)、JAN+コビメチニブ(COB)、Vismodegibなど)の適応外使用を検討するマルチバスケット型第2a相試験であり、そのうち今回はHER2 遺伝子増幅を有する切除不能大腸癌に対するHER+PERの有効性とバイオマーカー解析の中間解析結果が報告する。
シェーマ
主な適格基準
1) HER2 遺伝子増幅あり(CLIA認定施設による検査)
2) ECOG PS 0-2
3)一次治療が終了している
4) 主治医判断で、臨床的有効性が期待される他の治療がない
HER2 遺伝子増幅の定義
- FISH/CISH法によってHER2シグナル総数/CEP17シグナル総数比(HER2/CEP17 比)が2以上、またはHER2 copy numberが6以上であること
統計学的事項
主要評価項目:客観的奏効割合(研究者による評価)
サンプルサイズの設定根拠:
閾値奏効割合を10%、期待奏効割合を25%と設定し、α=0.10、1-β=0.80とし、Simonsの二段階デザインに基づき症例数を計算すると、第1ステージでは13例中2例の奏効が、第2ステージでは34例中6例の奏効が必要とされた。十分な検討のため、最大75例までの登録が可能と設定された。
試験結果:
- 2014年11月から2017年6月までに360例がMyPathway試験に登録され、57例のHER2遺伝子増幅陽性切除不能大腸癌患者にHER+PERが施行された。
- 前治療レジメン数の中央値は4レジメン、43例(75%)でKRAS 野生型、直腸原発が20例(35%)、左側結腸原発が23例(40%)、右側結腸原発が13例(23%)、原発部位不明が1例(2%)であった。
- Simonsの二段階デザインにおける第1ステージでは13例中2例でPRが得られ、第2ステージに移行した。
- 2017年8月1日時点(データカットオフ日)で、57例中7例が試験治療を継続し、18例が追跡中、32例が試験終了となっていた。
- 57例全例が各施設におけるNGSまたはFISH/CISHによってHER2 遺伝子増幅が確認されていた。NGSとFISH/CISH両方の検査結果が得られた症例における、検査結果一致率は81%(26/32)であった。
- HER2の免疫組織化学染色(IHC)は35例で行われ、27例(77%)でHER2強陽性を認めた。
1. 客観的奏効割合(主要評価項目)
| レジメン | N | 奏効割合 | 95%信頼区間 |
|---|---|---|---|
| HER+PER | 57 | 32% | 20-45 |
2. 病勢制御割合
| レジメン | N | 奏効割合 | 95%信頼区間 |
|---|---|---|---|
| HER+PER | 57 | 44% | 31-58 |
3. 奏効期間
| レジメン | N | 奏効割合 | 95%信頼区間 | 12か月以上奏効割合 |
|---|---|---|---|---|
| HER+PER | 18 | 5.9か月 | 2.8-11.1 | 22% |
4. 無増悪生存期間
| レジメン | N | 中央値 | 95%信頼区間 |
|---|---|---|---|
| HER+PER | 57 | 2.9か月 | 1.4-5.3 |
5. 全生存期間
| レジメン | N | 中央値 | 95%信頼区間 |
|---|---|---|---|
| HER+PER | 57 | 11.5か月 | 7.7-Not evaluable |
6. 有害事象
| HER+PER N=57(%) | |||
|---|---|---|---|
| Grade 1-2 | Grade 3 | Grade 4 | |
| 下痢 | 17(30) | 2(4) | 0 |
| 倦怠感 | 18(32) | 0 | 0 |
| 嘔気 | 16(28) | 1(2) | 0 |
| 貧血 | 12(21) | 2(4) | 0 |
| 腹痛 | 10(18) | 1(2) | 0 |
| 悪寒 | 13(23) | 0 | 0 |
| 呼吸困難 | 11(19) | 1(2) | 0 |
| 嘔吐 | 10(18) | 1(2) | 0 |
| インフュージョンリアクション | 9(16) | 1(2) | 0 |
| ALP上昇 | 7(12) | 2(4) | 0 |
| 食欲低下 | 8(14) | 1(2) | 0 |
| ビリルビン上昇 | 6(11) | 2(4) | 0 |
| 咳嗽 | 7(12) | 0 | 0 |
| 不眠症 | 7(12) | 0 | 0 |
| 皮膚乾燥 | 6(11) | 0 | 0 |
| 末梢性浮腫 | 6(11) | 0 | 0 |
| 発熱 | 6(11) | 0 | 0 |
| 発疹 | 6(11) | 0 | 0 |
| AST上昇 | 4(7) | 2(4) | 0 |
| 低カリウム血症 | 4(7) | 2(4) | 1(2) |
| 低ナトリウム血症 | 4(7) | 2(4) | 0 |
| 尿路感染症 | 5(9) | 1(2) | 1(2) |
| 急性腎障害 | 0 | 1(2) | 0 |
| ALT上昇 | 4(7) | 1(2) | 0 |
| 蜂巣炎 | 1(2) | 1(2) | 0 |
| 慢性閉塞性肺疾患 | 0 | 1(2) | 0 |
| クロストリジウム腸炎 | 0 | 1(2) | 0 |
| デバイス感染 | 0 | 1(2) | 0 |
| 顔面痛 | 0 | 1(2) | 0 |
| 感染症 | 0 | 1(2) | 0 |
| リンパ球数減少 | 3(5) | 1(2) | 0 |
| リンパ球減少症 | 0 | 1(2) | 0 |
| 非心原性胸痛 | 0 | 1(2) | 0 |
| 眼部帯状疱疹 | 0 | 1(2) | 0 |
| 胸水 | 0 | 1(2) | 0 |
| 小腸閉塞 | 0 | 1(2) | 1(2) |
| 脊髄圧迫 | 0 | 1(2) | 0 |
| 上腸間膜静脈症候群 | 0 | 1(2) | 0 |
| 失神 | 0 | 1(2) | 0 |
| 左室機能障害 | 0 | 0 | 1(2) |
- 治療関連有害事象は43例(75%)に認めた、うち2例(4%)が重篤であった(インフュージョンリアクション1例、悪寒1例)。
- 治療関連死亡は認めなかった。
7. サブ解析
- HER2 以外の遺伝子statusや抗EGFR抗体薬の投与歴、原発部位、過去の治療レジメン数に関してサブグループ解析が実施された。
| 奏効割合 N(%) |
病勢制御割合 N(%) |
奏効期間 中央値(か月) |
無増悪生存期間 中央値(か月) |
全生存期間 中央値(か月) |
|
|---|---|---|---|---|---|
| 全症例 | 18(32) | 25(44) | 5.9 | 2.9 | 11.5 |
| KRAS(n=56) | |||||
| 野生型(n=43) | 17(40) | 24(56) | 6.1 | 5.3 | 14.0 |
| 変異型(n=13) | 1(8) | 1(8) | 2.7 | 1.4 | 8.5 |
| PIK3CA(n=48) | |||||
| 野生型(n=40) | 17(43) | 23(58) | 6.1 | 5.3 | 14.0 |
| 変異型(n=8) | 1(13) | 2(25) | 4.4 | 1.4 | 7.3 |
| MSI status(n=28) | |||||
| Low or Stable(n=28) | 7(25) | 10(36) | 3.9 | 2.7 | 7.7 |
| High(n=0) | NA | NA | NA | NA | NA |
| 抗EGFR抗体薬既治療歴(KRAS 野生型)(n=43) | |||||
| 有(n=31) | 11(36) | 16(52) | 5.9 | 4.1 | 11.5 |
| 無(n=21) | 6(50) | 8(67) | 6.9 | 5.6 | NE |
| 原発部位(n=56) | |||||
| 左側結腸(n=23) | 8(35) | 12(52) | 9.0 | 4.1 | 22.1 |
| 右側結腸(n=12) | 1(8) | 2(17) | 10.3 | 1.4 | 5.7 |
| 横行結腸(n=1) | 1(100) | 1(100) | 2.8 | 5.3 | 7.7 |
| 直腸(n=20) | 8(40) | 10(50) | 4.3 | 2.8 | 10.3 |
| 転移臓器個数(n=57) | |||||
| <4(n=25) | 8(32) | 10(40) | 5.9 | 2.8 | NE |
| ≧4(n=32) | 10(31) | 15(47) | 5.9 | 3.0 | 10.3 |
NA:Not Applicable
結語
抗HER2併用療法であるHER+PERは治療歴を有するHER2 増幅陽性切除不能大腸癌に対して有効かつ安全であり、治療選択肢となりうる。
関連論文
1) Sartore-Bianchi A, et al. Pertuzumab and trastuzumab emtansine in patients with HER2-amplified metastatic colorectal cancer: the phase II HERACLES-B trial. ESMO Open. 2020;5(5):e000911.
2) Hainsworth JD, et al. Targeted Therapy for Advanced Solid Tumors on the Basis of Molecular Profiles: Results From MyPathway, an Open-Label, Phase IIa Multiple Basket Study. J Clin Oncol. 2018;36(6):536-42.
執筆:愛知県がんセンター病院 薬物療法部 レジデント 松原 裕樹 先生
監修:愛知県がんセンター病院 薬物療法部 医長 舛石 俊樹 先生
監修:愛知県がんセンター病院 薬物療法部 医長 舛石 俊樹 先生