| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 切除不能大腸癌 | 二次治療 | 第3相試験 | 全生存期間 | イギリス | なし |
試験名 :PICCOLO
レジメン:パニツムマブ+イリノテカン併用療法 vs. イリノテカン単剤療法
登録期間:2006年12月〜2010年8月
背景
- 2006年12月にUK Colorectal Clinical Studies Groupはフルオロウラシルに抵抗性となった切除不能大腸癌を対象に、PICCOLO試験を開始した。本試験を開始した時点では、従来の臨床病理学的基準に基づき、イリノテカン(IRI)単剤療法群、IRI+シクロスポリン併用療法群、IRI+パニツムマブ(PANI)併用療法群の3群にランダム化する試験デザインであった。
- 2008年4月にKRAS 変異が抗EGFR抗体薬の負の効果予測因子であることがランダム化試験の後方視的解析より報告され、その他のランダム化試験でも同様な結果が続けざまに報告された。
- この結果を受け、PICCOLO試験のマネジメントグループ及び独立データモニタリング・倫理委員会は、本試験の目的を、非選択集団ではなく、KRAS 野生型切除不能大腸癌に対するPANIの上乗せ効果の評価と、さらなるバイオマーカーの評価を行うことに変更した。2008年6月より、KRAS 変異例はIRI+PANI併用療法へのランダム化から除外された。
- 本報告では、抗EGFR抗体薬未治療のKRAS 野生型切除不能大腸癌を対象とし、IRI単剤療法とIRI+PANI併用療法の比較について最終結果を報告する。
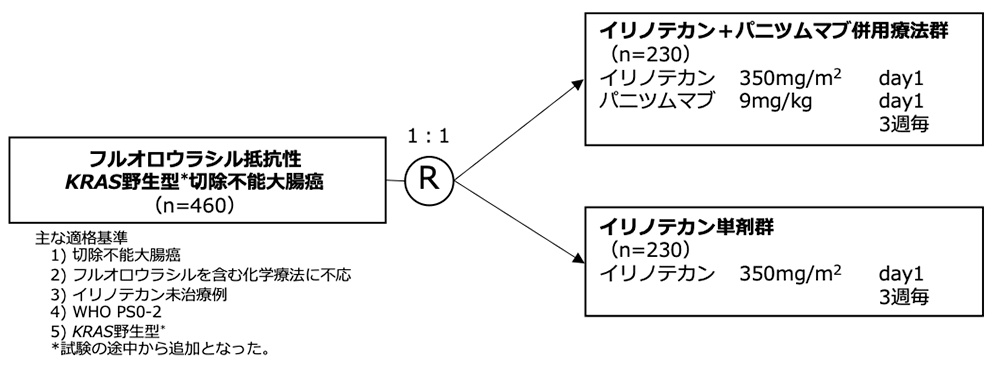
シェーマ
統計学的事項
主要評価項目:全生存期間
- 当初は、IRIにPANIを上乗せすることにより、主要評価項目である全生存期間のハザード比が25%低下することを検証するために試験が計画され(80%の検出力、5%の有意水準、両側ログランク検定)、目標サンプルサイズは720例と設定された。
- 変更後の試験デザインでは、KRAS コドン12, 13, 61野生型の患者を対象とし、PANIの上乗せにより、全生存期間のハザード比が30%低下することを検証するために、目標サンプルサイズを466例、必要イベント数が少なくとも246例発生した時点で解析を行う予定とした。
試験結果:
- 2006年12月に開始されたPICCOLO試験に、1198名の患者が登録された。最初の3群間比較試験(2006年12月~2008年6月)に494例、KRAS 変異あるいは不明の患者をIRI+PANI併用療法群から除外する一時的なsafety protocol(2008年6月~8月)に78例、完全な前向き層別化試験(2008年9月~2010年8月)に626例の患者が組み入れた。計460例の抗EGFR抗体薬の治療歴のないKRAS 野生型患者が、IRI単剤群(230例)またはIRI+PANI併用療法群(230例)に無作為に割り付けられ、これらが本報告の主解析の対象集団となった。
- ベースラインの患者背景は、両群間で偏りはなく、多くの患者がフルオロウラシルに加えてオキサリプラチンを投与され、ベバシズマブを投与された患者はほとんどいなかった。
- 主解析は246例のイベント発生後に開始されたが、データベースのロックを行った時点では、460例中312例(68%)にイベントを認めた。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR, p-value | |
| IRI+PANI併用療法 | 10.4ヶ月 | 8.9-12.2 | HR 1.01(0.83-1.23) p=0.91 |
| IRI単剤療法 | 10.9ヶ月 | 9.5-12.5 |
2. 無増悪生存期間
| HR, p-value | |
| IRI+PANI併用療法 | HR 0.78(0.64-0.95) p=0.015 |
| IRI単剤療法 |
3. 奏効割合
| 奏効割合 | OR, p-value | |
| IRI+PANI併用療法 | 34% | OR 4.12 (2.52-6.76) P<0.0001 |
| IRI単剤療法 | 12% |
4. 有害事象
| IRI+PANI併用療法 (N=219) | IRI単剤療法 (N=218) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Grade 1 | Grade 2 | Grade 3 | Grade 4 | Grade 5 | Grade 1 | Grade 2 | Grade 3 | Grade 4 | Grade 5 | |
| 悪心 | 86 (39%) |
40 (18%) |
20 (9%) |
0 | 0 | 91 (42%) |
41 (19%) |
13 (6%) |
0 | 0 |
| 嘔吐 | 46 (21%) |
32 (15%) |
13 (6%) |
2 (1%) |
0 | 44 (20%) |
36 (16%) |
15 (7%) |
0 | 0 |
| 下痢(点滴後24時間以降) | 67 (31%) |
64 (29%) |
59 (27%) |
4 (2%) |
1 (<0·5%) |
86 (40%) |
49 (22%) |
38 (17%) |
0 | 1 (<0·5%) |
| 下痢(点滴後24時間以内) | 18 (8%) |
16 (7%) |
1 (<0·5%) |
1 (<0·5%) |
0 | 17 (8%) |
8 (4%) |
3 (1%) |
0 | 0 |
| 便秘 | 54 (25%) |
23 (11%) |
0 | 0 | 0 | 64 (29%) |
17 (8%) |
0 | 1 (<0·5%) |
0 |
| 腹痛 | 58 (26%) |
23 (11%) |
14 (6%) |
0 | 0 | 61 (28%) |
38 (17%) |
12 (6%) |
0 | 0 |
| 皮膚毒性 | 50 (23%) |
103 (47%) |
40 (18%) |
1 (<0·5%) |
0 | 47 (22%) |
8 (4%) |
0 | 0 | 0 |
| 爪毒性 | 51 (23%) |
11 (5%) |
5 (2%) |
25 (11%) |
0 | 0 | ||||
| 脱毛 | 70 (32%) |
112 (51%) |
43 (20%) |
141 (65%) |
||||||
| 無気力症 | 67 (31%) |
75 (34%) |
43 (20%) |
2 (1%) |
0 | 78 (36%) |
78 (36%) |
24 (11%) |
0 | 0 |
| 頭痛 | 24 (11%) |
2 (1%) |
0 | 0 | 0 | 26 (12%) |
8 (4%) |
0 | 0 | 0 |
| めまい | 35 (16%) |
4 (2%) |
2 (1%) |
0 | 0 | 36 (17%) |
4 (2%) |
2 (1%) |
0 | 0 |
| 悪寒、発熱 | 38 (17%) |
13 (6%) |
2 (1%) |
2 (1%) |
0 | 33 (15%) |
3 (1%) |
5 (2%) |
0 | 0 |
| 感染(FNを除く) | 7 (3%) |
26 (12%) |
38 (17%) |
4 (2%) |
0 | 14 (6%) |
19 (9%) |
19 (9%) |
1 (<0·5%) |
2 (1%) |
| 好中球数減少 | 27 (12%) |
15 (7%) |
18 (8%) |
30 (14%) |
0 | 19 (9%) |
20 (9%) |
8 (4%) |
17 (8%) |
2 (1%) |
| 血小板数減少 | 26 (12%) |
4 (2%) |
4 (2%) |
1 (<0·5%) |
0 | 16 (7%) |
1 (<0·5%) |
0 | 0 | 0 |
| 貧血 | 98 (45%) |
22 (10%) |
7 (3%) |
1 (<0·5%) |
0 | 91 (42%) |
27 (12%) |
2 (1%) |
1 (<0·5%) |
0 |
5. 探索的解析
- BRAF コドン600、NRASコドン12, 13, 61、KRAS コドン 146、PICK3CAの遺伝子変異とPANIの上乗せ効果との相互作用を検討する目的で、探索的解析が行われた。
- まず遺伝子変異と予後の関連について、IRI単剤群のコホートにおいて評価した。全野生例に比較して、上記遺伝子変異のいずれかの変異を有する症例は予後不良であった(p=0.049)。特にBRAF 変異型例では、全野生型例に比較して、ハザード比 1.56 (1.03-2.37) と予後不良であった。
- 次に遺伝子変異の有無(全野生型例 vs. いずれかの変異を有する症例)とPANIの全生存期間および無増悪生存期間、奏効割合に対する影響を、交互作用検定を用いて評価を行ったところ、全生存期間(p=0.028)、無増悪生存期間(p=0.018)、奏効割合(p=0.0095)の3つのエンドポイントすべてにおいて、交互作用を認めた。
- 全野生型例では、IRI単剤群よりもIRI+PANI併用療法群の方が、無増悪生存期間と奏効割合が高かったが、全生存期間の延長を認めなかった(ハザード比 0.92 [0.73-1.16])。
- 一方、いずれかの変異を有する症例において、PANIは無増悪生存期間および奏効割合に上乗せを及ぼさず、さらに全生存期間には悪影響を及ぼした(ハザード比1.64 [1.144-2.34])。
- 個々の変異については、症例数が少なく探索的な結果ではあるが、BRAF 変異型例にはPANIは、全生存期間および無増悪生存期間において負の効果を有することが示唆された(ハザード比 1.84 [1.10-3.08])。
結語
KRAS 野生型の切除不能大腸癌に対して、IRIにPANIを併用しても、全生存期間の延長を示すことはできなかった。抗EGFR抗体薬の効果を最大化するようなバイオマーカーの探索が必要である。
関連論文
1) Middleton G, Brown S, Lowe C, et al. A randomised phase III trial of the pharmacokinetic biomodulation of irinotecan using oral ciclosporin in advanced colorectal cancer: Results of the Panitumumab, Irinotecan & Ciclosporin in COLOrectal cancer therapy trial (PICCOLO). Eur J Cancer 2013;49(16):3507–16.
執筆:国立がん研究センター東病院 消化管内科 中島 裕理 先生
監修:愛知県がんセンター病院 薬物療法部 医長 坂東 英明 先生
監修:愛知県がんセンター病院 薬物療法部 医長 坂東 英明 先生