| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 一次治療 | 第3相 | 無増悪生存期間 | 国際 | なし |
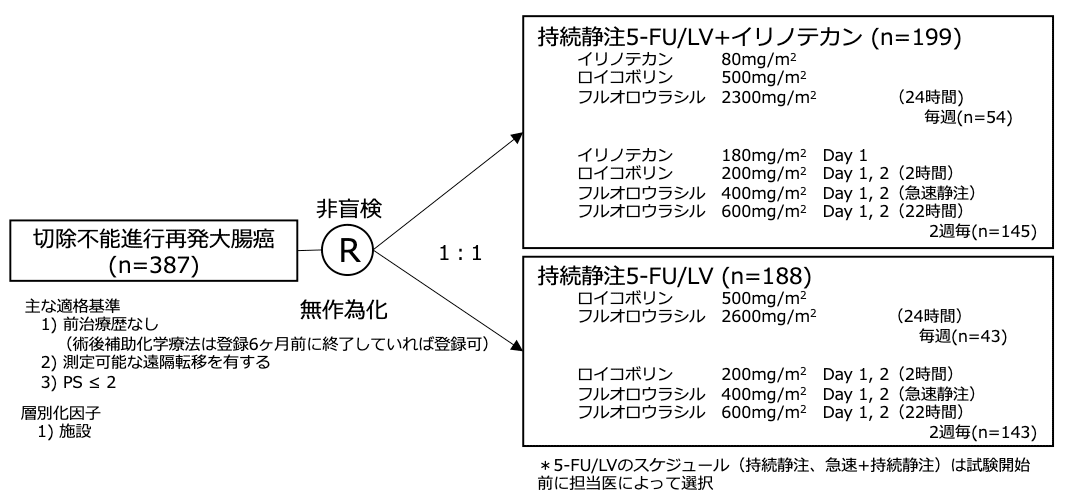
試験名 :V303
レジメン:持続静注5-FU/LV+イリノテカン vs 持続静注5-FU/LV
登録期間:1997年5月〜1998年2月
背景
切除不能進行大腸癌に対する標準治療は5-FU/LVで、生存期間の中央値は10-14ヶ月であった。イリノテカンは5-FUと交差耐性のない分子メカニズムで作用し、5-FUを用いた1次治療が不応となった場合、2次治療としてイリノテカンがbest supportive careや5-FU/LV単独より全生存期間を延長することが第III相試験で示された。以上より、5-FU/LVとイリノテカンの併用療法の効果が期待され、1次治療として持続静注5-FU/LV+イリノテカン併用療法の有用性を検証する第3相試験(V303)が実施された。
シェーマ
統計学的事項
主要評価項目:奏効割合
対象となる持続静注5-FU/LV群で35%、試験治療の持続静注5-FU/LV+イリノテカン群で50%となることを検証(両側α=0.05、検出力=80%)。必要症例数は計338例。
試験結果:
- 1997年5月〜1998年2月の間に15カ国(欧州 13ヶ国、イスラエル、南アフリカ)より387例が登録された。
- 385例がプロトコール治療を受け、2例は同意を撤回したためプロトコール治療を受けなかった。
- レジメンは97例(25%)が毎週投与(持続静注5-FU/LV+イリノテカン 54例、持続静注5-FU/LV 43例)で、288例が隔週投与であった(持続静注5-FU/LV+イリノテカン 145例、持続静注5-FU/LV 143例)。
- 両群の患者背景に大きな隔たりはなかったが、前治療歴(手術)は持続静注5-FU/LV+イリノテカン群89%に対して持続静注5-FU/LV群が95%と高かった。
- 観察期間中央値は23.3ヶ月。
1. 奏効割合(ITT)(主要評価項目)
| 奏効割合 | 95%信頼区間 | P = 0.005 | |
| 持続静注5-FU/LV+イリノテカン | 34.8% | 28.2-41.9 | |
| 持続静注5-FU/LV | 21.9% | 16.2-28.5 |
2. 全生存期間
| 中央値 | 範囲 | P = 0.031 | |
| 持続静注5-FU/LV+イリノテカン | 17.4ヶ月 | 0.4-28.4+ | |
| 持続静注5-FU/LV | 14.1ヶ月 | 0.5-27.6+ |
3. 無増悪期間
| 中央値 | 範囲 | P < 0.001 | |
| 持続静注5-FU/LV+イリノテカン | 6.7ヶ月 | 0+-13.8+ | |
| 持続静注5-FU/LV | 4.4ヶ月 | 0+-11.8+ |
4. 奏効期間(奏効例のうち、増悪なく生存)
| 中央値 | 範囲 | P = 0.08 | |
| 持続静注5-FU/LV+イリノテカン | 9.3ヶ月 | 2.8-13.1 | |
| 持続静注5-FU/LV | 8.8ヶ月 | 3.7-11.8 |
5. 治療期間
| 中央値 | |
|---|---|
| 持続静注5-FU/LV+イリノテカン 毎週投与 隔週投与 |
24.0週 24.6週 |
| 持続静注5-FU/LV 毎週投与 隔週投与 |
21.0週 18.0週 |
6. 有害事象(隔週投与)
| 持続静注5-FU/LV+イリノテカン (n=154) |
持続静注5-FU/LV (n=143) |
P(Grade3/4) |
|||
|---|---|---|---|---|---|
| 全Grade | Grade 3/4 | 全Grade | Grade 3/4 | ||
| 下痢 | 48 (88.9%) | 24 (44.4%) | 28 (65.1%) | 11 (25.6%) | 0.055 |
| 悪心 | 39 (72.2%) | 4 (7.4%) | 25 (58.1%) | 2 (4.7%) | 0.57 |
| 嘔吐 | 30 (55.6%) | 6 (11.1%) | 19 (44.2%) | 2 (4.7%) | 0.25 |
| 脱力 | 23 (42.6%) | 4 (7.4%) | 6 (14.0%) | -- | 0.068 |
| 脱毛症 | 20 (37.0%) | -- | 7 (16.3%) | -- | -- |
| 食思不振 | 16 (29.6%) | 4 (7.4%) | 6 (14.0%) | 1 (2.3%) | 0.26 |
| 粘膜炎 | 14 (25.9%) | -- | 15 (34.9%) | 1 (2.3%) | 0.26 |
| 腹痛 | 12 (22.2%) | 3 (5.6%) | 1 (2.3%) | 1 (2.3%) | 0.47 |
| コリン作用 | 11 (20.4%) | 1 (1.9%) | -- | -- | 0.37 |
| 手足症候群 | 9 (16.7%) | -- | 17 (39.5%) | 2 (4.7%) | 0.11 |
| 好中球減少のない発熱 | 6 (11.3%) | -- | 4 (9.3%) | -- | -- |
| 皮膚障害 | 4 (7.4%) | -- | 4 (9.3%) | -- | -- |
| 疼痛 | 4 (7.4%) | 1 (1.9%) | 6 (14.0%) | 1 (2.3%) | 0.87 |
| 体重減少 | 4 (7.4%) | 1 (1.9%) | -- | -- | 0.37 |
| 好中球減少のない感染 | 2 (3.7%) | -- | 2 (4.7%) | -- | -- |
| 貧血 | 51 (94.4%) | 3 (5.6%) | 41 (97.6%) | -- | 0.12 |
| 好中球減少 | 37 (71.2%) | 15 (28.8%) | 9 (21.4%) | 1 (2.4%) | 0.001 |
| 白血球減少 | 40 (74.1%) | 11 (20.4%) | 16 (38.1%) | 1 (2.4%) | 0.009 |
| 好中球減少のある発熱 | 5 (9.3%) | 5 (9.3%) | 1 (2.3%) | 1 (2.4%) | 0.16 |
| 好中球減少のある感染 | 1 (1.9%) | 1 (1.9%) | -- | -- | 0.37 |
7. 有害事象(毎週投与)
| 持続静注5-FU/LV+イリノテカン (n=54) |
持続静注5-FU/LV (n=43) |
P(Grade3/4) |
|||
|---|---|---|---|---|---|
| 全Grade | Grade 3/4 | 全Grade | Grade 3/4 | ||
| 下痢 | 99 (68.3%) | 19 (13.1%) | 55(38.5%) | 8 (5.6%) | 0.028 |
| 悪心 | 85 (58.6%) | 3 (2.1%) | 71 (49.7%) | 2 (1.4%) | 0.66 |
| 脱毛症 | 82 (56.6%) | -- | 24 (16.8%) | -- | -- |
| 脱力 | 65 (44.8%) | 9 (6.2%) | 50 (35.0%) | 1 (0.7%) | 0.011 |
| 嘔吐 | 60 (41.4%) | 4 (2.8%) | 40 (28.0%) | 1 (0.7%) | 0.18 |
| 粘膜炎 | 56 (38.6%) | 6 (4.1%) | 41 (28.7%) | 3 (2.1%) | 0.32 |
| コリン作用 | 41 (28.3%) | 2 (1.4%) | 1 ( 0.7%) | -- | 0.16 |
| 食思不振 | 25 (17.2%) | 3 (2.1%) | 9 (6.3%) | 1 (0.7%) | 0.32 |
| 皮膚障害 | 16 (11.0%) | 1 (0.7%) | 24 (16.8%) | -- | 0.32 |
| 腹痛 | 14 (9.7%) | 1 (0.7%) | 7 (4.9%) | -- | 0.32 |
| 手足症候群 | 13 (9.0%) | 1 (0.7%) | 18 (12.6%) | 1 (0.7%) | 0.99 |
| 疼痛 | 12 (8.3%) | -- | 7 (4.9%) | 1 (0.7%) | 0.31 |
| 好中球減少のない発熱 | 9 (6.2%) | -- | 6 (4.2%) | 1 (0.7%) | -- |
| 好中球減少のない感染 | 7 (4.8%) | 4 (2.8%) | 5 (3.5%) | -- | 0.045 |
| 体重減少 | 6 (4.1%) | 2 (1.4%) | 2 (1.4%) | -- | 0.16 |
| 貧血 | 140 (97.2%) | 3 (2.1%) | 130 (90.9%) | 3 (2.1%) | 0.99 |
| 好中球減少 | 118 (82.5%) | 66 (46.2%) | 68 (47.9%) | 19 (13.4%) | 0.001 |
| 白血球減少 | 117 (81.3%) | 25 (17.4%) | 60 (42.0%) | 5 (3.5%) | 0.001 |
| 好中球減少のある発熱 | 5 (3.4%) | 5 (3.4%) | 1 (00.7%) | 1 (00.7%) | 0.10 |
| 好中球減少のある感染 | 3 (2.1%) | 3 (2.1%) | -- | -- | 0.08 |
8. 相対用量強度(Relative dose intensity:RDI)
| 持続静注5-FU/LV+イリノテカン | 持続静注5-FU/LV | ||
|---|---|---|---|
| イリノテカン | 5-FU | 5-FU | |
| 毎週投与 | 0.82 | 0.81 | 0.90 |
| 隔週投与 | 0.93 | 0.92 | 0.96 |
9. 2次治療移行割合
| 2次治療移行割合 | イリノテカンを含むレジメン | オキサリプラチンを含むレジメン | |
|---|---|---|---|
| 持続静注5-FU/LV+イリノテカン | 39.4% | -- | 15.7% |
| 持続静注5-FU/LV | 58.3% | 31.0% | 12.8% |
結語
切除不能進行再発大腸癌に対する初回治療として、持続静注5-FU/LV+イリノテカン療法は持続静注5-FU/LV療法に対し、奏効割合、無増悪期間および全生存期間で有意に優れ、Grade3/4の有害事象は、下痢や好中球減少が多かったものの認容性は許容可能であった。以上より、持続静注5-FU/LV+イリノテカン療法は切除不能進行再発大腸癌に対する標準治療と考えるべきである。
執筆:静岡県立静岡がんセンター 消化器内科 レジデント 瀧浪 将貴先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎先生