| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 一次治療 | 第3相 | 無増悪生存期間 | 国内 | あり |
試験名 :WJOG4407G
レジメン:FOLFIRI+BEV vs mFOLFOX6+BEV
登録期間:2008年9月〜2012年1月
背景
FOLFIRI(急速静注/持続静注5-FU/LV+イリノテカン)→ FOLFOX(急速静注/持続静注5-FU/LV+オキサリプラチン)の逐次治療とFOLFOX → FOLFIRIの逐次治療は、同程度の全生存期間であることが第3相試験(V308)で示されたことから、切除不能進行再発大腸癌に対する一次治療として両レジメンは同程度の抗腫瘍効果があると認識されている。
IFL(イリノテカン+急速静注5-FU/LV)に対するベバシズマブ(BEV)の併用は全生存期間における上乗せ効果が第3相試験(AVF2107g)で示された。またFOLFIRI+BEVは無増悪生存期間が10~12ヶ月と良好な成績が複数の第2相試験で報告され、さらにmodified IFL+BEVと比較して全生存期間を改善する可能性が第2相試験より示唆されていたが、一次治療としてFOLFIRIにおけるBEV併用の上乗せ効果は第3相試験で検証されていなかった。一方、オキサリプラチンベースの化学療法に関しては、FOLFOX/CAPOX(カペシタビン+オキサリプラチン)に対するBEV併用の無増悪生存期間における上乗せ効果が第3相試験(NO16966)で示された。
これらの結果より、FOLFOX/CAPOX+BEVとFOLFIRI+BEVを直接比較した第3相試験は実施されていないものの、いずれも一次治療における標準治療とみなされていた。
しかし両療法の毒性は、FOLFIRIの消化器毒性や脱毛症、FOLFOXのオキサリプラチン関連感覚性末梢神経障害といったようにプロファイルが異なる。また感覚性末梢神経障害は増悪前のオキサリプラチン中止に繋がり、中止後も長期間持続することから、これらの毒性プロファイルの違いがQoLに影響する可能性がある。
以上より、切除不能進行再発大腸癌に対する一次治療としてFOLFIRI+BEVのmFOLFOX6+BEVに対する無増悪生存期間における非劣性を検証するために第3相試験(WJOG4407G)を実施した。
IFL(イリノテカン+急速静注5-FU/LV)に対するベバシズマブ(BEV)の併用は全生存期間における上乗せ効果が第3相試験(AVF2107g)で示された。またFOLFIRI+BEVは無増悪生存期間が10~12ヶ月と良好な成績が複数の第2相試験で報告され、さらにmodified IFL+BEVと比較して全生存期間を改善する可能性が第2相試験より示唆されていたが、一次治療としてFOLFIRIにおけるBEV併用の上乗せ効果は第3相試験で検証されていなかった。一方、オキサリプラチンベースの化学療法に関しては、FOLFOX/CAPOX(カペシタビン+オキサリプラチン)に対するBEV併用の無増悪生存期間における上乗せ効果が第3相試験(NO16966)で示された。
これらの結果より、FOLFOX/CAPOX+BEVとFOLFIRI+BEVを直接比較した第3相試験は実施されていないものの、いずれも一次治療における標準治療とみなされていた。
しかし両療法の毒性は、FOLFIRIの消化器毒性や脱毛症、FOLFOXのオキサリプラチン関連感覚性末梢神経障害といったようにプロファイルが異なる。また感覚性末梢神経障害は増悪前のオキサリプラチン中止に繋がり、中止後も長期間持続することから、これらの毒性プロファイルの違いがQoLに影響する可能性がある。
以上より、切除不能進行再発大腸癌に対する一次治療としてFOLFIRI+BEVのmFOLFOX6+BEVに対する無増悪生存期間における非劣性を検証するために第3相試験(WJOG4407G)を実施した。
シェーマ
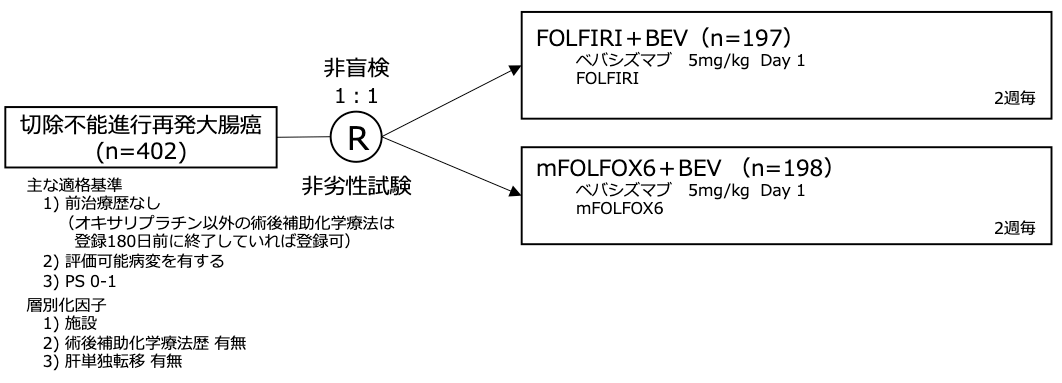
統計学的事項
主要評価項目:無増悪生存期間
mFOLFOX6+BEVを対照としてFOLFIRI+BEVの非劣性を検証。既報よりmFOLFOX6+BEV、FOLFIRI+BEVの無増悪生存期間中央値を各々10ヶ月、11ヶ月と推定し、非劣性マージンはHR 1.25、片側α=0.025、検出力=85%と設定。非劣性が検証された場合はmFOLFOX6+BEVに対するFOLFIRI+BEVの優越性も検証。必要イベント数は計323イベント、必要症例数は計400例。試験結果:
- 2008年9月〜2012年1月の間に43施設より402例が登録された(FOLFIRI+BEV群 202例、mFOLFOX6+BEV群 200例)。
- FOLFIRI+BEV群 5例、mFOLFOX6+BEV群 2例は無作為化後に選択基準を満たさないことが判明し、主解析からは除外された。
- 患者背景は両群に大きな隔たりはなかった。
- 無増悪生存期間の主解析のデータカットオフは2013年7月6日で、観察期間中央値はFOLFIRI+BEV群 29.3ヶ月、mFOLFOX6+BEV群 32.6ヶ月で、312イベントが観察された。
- 全生存期間の最終解析は観察期間中央値がFOLFIRI+BEV群 51.9ヶ月、mFOLFOX6+BEV群 50.8ヶ月の時点で実施され、死亡は各々142例(72.1%)、146例(73.3%)に認められた。
1. 無増悪生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.905 (95%C.I. 0.723-1.133) P = 0.003(非劣性) P = 0.427(優越性) |
|
| FOLFIRI+BEV | 12.1ヶ月 | 11.0-13.8 | |
| mFOLFOX6+BEV | 10.7ヶ月 | 9.9-12.1 |
2. 全生存期間
| 中央値 | 95%信頼区間 | HR 0.990 (95%C.I. 0.785-1.249) P = 0.730(優越性) |
|
| FOLFIRI+BEV | 31.4ヶ月 | 27.6-36.4 | |
| mFOLFOX6+BEV | 30.1ヶ月 | 26.8-35.5 |
3. 最良総合奏効割合(best overall response rate)
| 割合 | P = 0.757 | |
| FOLFIRI+BEV | 64% | |
| mFOLFOX6+BEV | 62% |
4. 転移巣切除
| 切除例数 | P = 0.736 | |
| FOLFIRI+BEV | 20 (10%) | |
| mFOLFOX6+BEV | 18 (9%) |
5. 治療中止理由
| FOLFIRI+BEV (n= 182) |
mFOLFOX6+BEV (n=192) |
|
|---|---|---|
| 増悪 | 52% | 45% |
| 有害事象 | 27% | 33% |
| 切除可能となり手術を企図 | 12% | 10% |
| 患者または主治医判断 | 9% | 11% |
6. 治療サイクル数
| 中央値 | 範囲 | |
|---|---|---|
| FOLFIRI+BEV | 15.0 | 1-63 |
| mFOLFOX6+BEV | 12.5 | 1-70 |
7. 治療成功期間(治療中または治療終了後、増悪なく生存)
| 中央値 | |
|---|---|
| FOLFIRI+BEV | 8.5ヶ月 |
| mFOLFOX6+BEV | 7.3ヶ月 |
8. 薬剤中止までの期間
| 中央値 | |
|---|---|
| イリノテカン | 8.5ヶ月 |
| オキサリプラチン | 5.1ヶ月 |
| BEV(FOLFIRI+BEV群) | 7.4ヶ月 |
| BEV(mFOLFOX6+BEV群) | 6.4ヶ月 |
9. 二次治療移行
| FOLFIRI+BEV (n=157) |
mFOLFOX6+BEV (n=168) |
|
|---|---|---|
| 二次治療の薬剤 | オキサリプラチン 63% BEV 51% 抗EGFR抗体薬 29% |
イリノテカン 62% BEV 55% 抗EGFR抗体薬 30% |
10. 有害事象(CTCAE ver.3.0)
| FOLFIRI+BEV (n=195) |
mFOLFOX6+BEV (n=198) |
P (Grade 3以上) |
|||||||
|---|---|---|---|---|---|---|---|---|---|
| Grade | 1 | 2 | 3 | 4 | 1 | 2 | 3 | 4 | |
| 白血球減少 | 49 (25%) | 86 (44%) | 20 (10%) | 2 (1%) | 70 (35%) | 68 (34%) | 9 (5%) | 0 (0%) | 0.014 |
| 好中球減少 | 22 (11%) | 61 (31%) | 59 (30%) | 30 (15%) | 34 (17%) | 54 (27%) | 56 (28%) | 14 (7%) | 0.031 |
| 血小板減少 | 6 (3%) | 0 (0%) | 1 (1%) | 0 (0%) | 17 (9%) | 16 (8%) | 1 (1%) | 0 (0%) | 1.00 |
| 貧血 | 31 (16%) | 34 (17%) | 7(4%) | 1 (1%) | 38 (19%) | 23 (12%) | 5 (3%) | 0 (0%) | 0.411 |
| 食思不振 | 65 (33%) | 62 (32%) | 16 (8%) | 0 (0%) | 89 (45%) | 44 (22%) | 10 (5%) | 1 (1%) | 0.320 |
| 倦怠感 | 74 (38%) | 61 (31%) | 11 (6%) | 0 (0%) | 76 (38%) | 58 (29%) | 5 (3%) | 1 (1%) | 0.223 |
| 悪心 | 73 (37%) | 57 (29%) | 13 (7%) | 0 (0%) | 89 (45%) | 31 (16%) | 9 (5%) | 0 (0%) | 0.387 |
| 嘔吐 | 44 (23%) | 29 (15%) | 9 (5%) | 0 (0%) | 38 (19%) | 10 (5%) | 9 (5%) | 0 (0%) | 1.00 |
| 粘膜炎 | 64 (33%) | 40 (21%) | 5 (3%) | 0 (0%) | 86 (43%) | 21 (11%) | 5 (3%) | 0 (0%) | 1.00 |
| 下痢 | 63 (32%) | 26 (13%) | 17 (9%) | 0 (0%) | 42 (21%) | 22 (11%) | 10 (5%) | 0 (0%) | 0.166 |
| 手足症候群 | 38 (20%) | 7 (4%) | 1 (1%) | 0 (0%) | 37 (19%) | 18 (9%) | 5 (3%) | 0 (0%) | 0.215 |
| アレルギー | 2 (1%) | 2 (1%) | 0 (0%) | 0 (0%) | 14 (7%) | 22 (11%) | 0 (0%) | 0 (0%) | - |
| 感覚ニューロパチー | 39 (20%) | 3 (2%) | 0 (0%) | 0 (0%) | 67 (34%) | 59 (30%) | 43 (22%) | 0 (0%) | <0.001 |
| 発熱 | 29 (15%) | 4 (2%) | 2 (1%) | 0 (0%) | 37 (19%) | 5 (3%) | 1 (1%) | 0 (0%) | 0.620 |
| 発熱性好中球減少 | - | - | 10 (5%) | 0 (0%) | - | - | 3 (2%) | 0 (0%) | 0.051 |
| 肺炎 | 2 (1%) | 1 (1%) | 0 (0%) | 0 (0%) | 2 (1%) | 1 (1%) | 1 (1%) | 0 (0%) | 1.00 |
| 腹痛 | 20 (10%) | 12 (6%) | 7 (4%) | 1 (1%) | 15 (8%) | 15 (8%) | 3 (2%) | 0 (0%) | 0.136 |
| 麻痺性イレウス | 0 (0%) | 0 (0%) | 2 (1%) | 0 (0%) | 0 (0%) | 0 (0%) | 2 (1%) | 1 (1%) | - |
| 脱毛症 | 108 (55%) | 19 (10%) | - | - | 66 (33%) | 2 (1%) | - | - | - |
| 高血圧 | 48 (25%) | 30 (15%) | 6 (3%) | 0 (0%) | 41 (21%) | 28 (14%) | 11 (6%) | 0 (0%) | 0.321 |
| 蛋白尿 | 47 (24%) | 30 (15%) | 0 (0%) | 0 (0%) | 48 (24%) | 37 (19%) | 0 (0%) | 0 (0%) | - |
| 消化管出血 | 23 (12%) | 1 (1%) | 0 (0%) | 0 (0%) | 12 (6%) | 0 (0%) | 1 (1%) | 0 (0%) | 1.00 |
| 鼻出血 | 53 (27%) | 1 (1%) | 0 (0%) | 0 (0%) | 57 (29%) | 1 (1%) | 0 (0%) | 0 (0%) | - |
| 静脈血栓症 | - | 5 (3%) | 12 (6%) | 0 (0%) | - | 6 (3%) | 3 (2%) | 0 (0%) | 0.017 |
| 動脈血栓症 | - | 1 (1%) | 3 (2%) | 0 (0%) | - | 0 (0%) | 1 (1%) | 0 (0%) | 0.365 |
| 消化管穿孔 | 0 (0%) | 0 (0%) | 5 (3%) | 1* (1%) | 0 (0%) | 1 (1%) | 2 (1%) | 1 (1%) | 0.331 |
* 消化管穿孔1例はGrade 5(死亡)
11. QoL
QoLはFACT/GOG-Ntx、FACT-C (TOI-PFC)を用いて評価された。評価ポイントは試験登録時、3、6、9、12、18ヶ月時点。
いずれの評価法でもFOLFIRI+BEV群がmFOLFOX6群よりも良好な傾向を認めた。
| 評価方法 | P |
|---|---|
| FACT/GOG-Ntx | < 0.001 |
| FACT-C (TOI-PFC) | = 0.296 |
結語
切除不能進行再発大腸癌に対する初回治療として、FOLFIRI+BEVはmFOLFOX6+BEVに対して無増悪生存期間における非劣性を示し、QoLも良好な傾向にあった。一次治療におけるFOLFIRI+BEVは標準治療の1つであることが確認された。
執筆:静岡県立静岡がんセンター 消化器内科 レジデント 瀧浪 将貴 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生