| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 進行食道扁平上皮癌 | 一次治療 | 第2相 | 奏効割合 | 欧州 | なし |
試験名 :(RP-II:CDDP±5-FU)
レジメン:シスプラチン vs シスプラチン+5-FU
登録期間:1985年9月〜1989年4月
背景
進行食道癌に対する治療は通過障害や嚥下困難からの症状緩和を主な目的として実施されてきた。たとえ、症状がなくても全身状態が悪く積極的な治療が困難な事が多い。
化学療法に関しては、これまで主に、局所進行例に対して時には放射線照射を併用しながら術前治療として検証され、シスプラチン+5-FU併用療法は12-44%の完全寛解割合、42-72%の奏効割合を報告してきた。
進行食道癌に対しては、シスプラチン併用療法の奏効割合が25-33%である一方、低い完全寛解割合、短い奏効期間、重篤な有害事象が報告されている。そこで、シスプラチン単剤療法であれば有害事象が少ないと想定され、5-FUとの併用療法よりも緩和されるのではないかと考えられ、シスプラチン単剤療法とシスプラチン+5-FU併用療法の安全性と有効性を評価する本試験が実施された。
化学療法に関しては、これまで主に、局所進行例に対して時には放射線照射を併用しながら術前治療として検証され、シスプラチン+5-FU併用療法は12-44%の完全寛解割合、42-72%の奏効割合を報告してきた。
進行食道癌に対しては、シスプラチン併用療法の奏効割合が25-33%である一方、低い完全寛解割合、短い奏効期間、重篤な有害事象が報告されている。そこで、シスプラチン単剤療法であれば有害事象が少ないと想定され、5-FUとの併用療法よりも緩和されるのではないかと考えられ、シスプラチン単剤療法とシスプラチン+5-FU併用療法の安全性と有効性を評価する本試験が実施された。
シェーマ
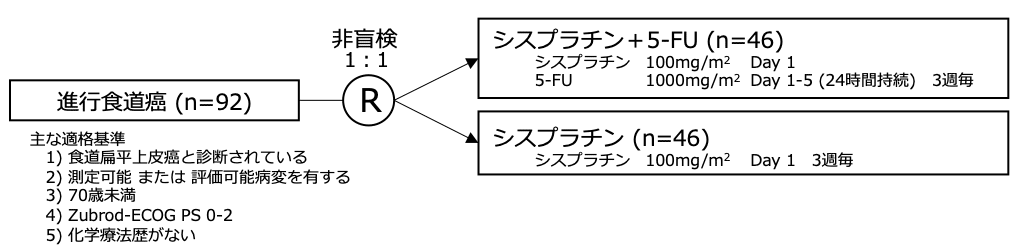
統計学的事項
主要評価項目:奏効割合
本試験のサンプルサイズの計算には、ECOGのtwo-stageデザインが用いられ、1段階目は各群それぞれ20例と設定され、その後、奏効例の数に応じて症例が5例ずつ、各群最大 40例まで登録することとした。どちらかの治療群の奏効率が20%を上回る場合に、そのレジメンは有効と判断され、どちらの群も5%を下回る場合は、有効性はなしと判断された。試験結果:
- 1985年9月〜1989年4月の間に92例が登録された。3例が不適格(高カルシウム血症 1例、組織学的検査が未実施 1例、腺癌 1例)、1例が縦隔への瘻孔形成により治療が実施されなかったために除外され、88例で解析が行われた。70〜72歳の症例が3例登録されたが、適格と判断された。
- 外部画像評価の結果、シスプラチン+5-FU群の10例、シスプラチン群の7例は測定可能病変を有していないと判断された。
1. 患者背景
- 患者背景は両群間でバランスがとれており、性別は両群とも男性42例、女性2例であった。
- 両群合わせて13例が外科的治療を受けており(11例:根治的切除、2例:姑息的切除)、10例は放射線照射歴を有していた(その内、6例は根治切除後の補助療法として)。
2. 投与状況
- 投与サイクル数の中央値は、シスプラチン+5-FU群 4サイクル(範囲 1-8)、シスプラチン群 3サイクル(範囲 1-11)であった。
- シスプラチンの総投与量は、シスプラチン+5-FU群 650mg(範囲 130-1260)、シスプラチン群 530mg(範囲 100-1857)であった。
- シスプラチン+5-FU群の17例(39%)、シスプラチン群の8例(18%)に投与延期を要し、薬剤関連の延期はそれぞれ9例/3例であった。
3. 奏効割合 (主要評価項目)
| N (%) | シスプラチン+5-FU (N=34) |
シスプラチン (N=37) |
|---|---|---|
| CR PR SD PD 早期死亡 未評価 |
1 (3) 11 (32) 10 (29) 6 (18) 5 (15) 1 (3) |
1 (3) 6 (16) 14 (38) 16 (43) 0 (0) 0 (0) |
| 奏効割合 (95%信頼区間) |
35% (20-54) |
19% (8-35) |
4. 奏効期間
| 症例数 | 中央値 | 範囲 | |
|---|---|---|---|
| シスプラチン+5-FU | 16 | 40週 | 18-182 |
| シスプラチン | 8 | 26週 | 15-87 |
5. 無増悪生存期間
| 症例数 | 中央値 | |
|---|---|---|
| シスプラチン+5-FU | 44 | 27週 |
| シスプラチン | 44 | 18週 |
6. 全生存期間
| N (%) | シスプラチン+5-FU (N=44) |
シスプラチン (N=44) |
|---|---|---|
| 中央値 | 33週 | 28週 |
| 1年生存割合 (95%信頼区間) |
34% (20-48) |
27% (14-40) |
| 2年生存割合 (95%信頼区間) |
18% (7-29) |
9% (1-17) |
7. 有害事象 (WHO grade 3-4)
| N (%) | シスプラチン+5-FU (n=44) |
シスプラチン (n=44) |
|---|---|---|
| 白血球減少 | 6 (14) | 0 (0) |
| 血小板数減少 | 6 (14) | 0 (0) |
| 悪心/嘔吐 | 12 (27) | 5 (11) |
| 下痢 | 1 (2) | 0 (0) |
| 粘膜炎 | 2 (4) | 0 (0) |
| 血栓症 | 4 (9) | 0 (0) |
- 白血球数・血小板数の最低値 中央値は、シスプラチン+5-FU群 3900/μL(範囲 300-2000)・15.4万/μL(範囲 1.6-52.0万)、シスプラチン群 4400/μL(範囲 2300-11100)・21.9万/μL(範囲 6.6-66.0万)であった。
- 発熱性好中球減少症を来した2例(いずれもシスプラチン+5-FU群)が敗血症で死亡した。
- 神経障害はGrade 2を越えなかった(聴力障害 n=2, 傾眠 n=1:いずれもシスプラチン群)。
- シスプラチン+5-FU群では4名(9%)の血管毒性を生じた(主要脳血管イベント n=3, 下肢急性血栓症 n=1(死亡に至った))。
8. 治療中止理由
| N (%) | シスプラチン+5-FU (N=44) |
シスプラチン (N=44) |
|---|---|---|
| 原疾患・有害事象以外による死亡* | 3 (7) | 0 (0) |
| 血管系イベントによる死亡** | 4 (9) | 0 (0) |
| 患者拒否 | 4 (9) | 4 (9) |
| 重篤な有害事象*** | 5 (11) | 3 (7) |
| 病勢進行 (原疾患による死亡も含む) | 19 (43) | 27 (61) |
| プロトコール逸脱 | 1 (2) | 1 (2) |
| その他**** | 8 (18) | 9 (20) |
* 肺炎(n=1), 敗血症(n=1), 非特異的感染症(n=1)、** 脳血管障害(n=3), 下肢の虚血(n=1)、*** シスプラチン+5-FU:敗血症(n=2), 髄膜出血(n=1), 腎障害(n=2)、シスプラチン:聴力障害(n=2), 腎障害(n=1)、**** シスプラチン+5-FU:手術(n=2), 放射線(n=6)、シスプラチン:その他の化学療法(n=1), 完全寛解(n=2), 自己中断(n=4), 不明(n=2)
結語
本試験はシスプラチン+5-FU併用療法がシスプラチン単剤よりも有効性を示したが、併用療法では重篤な有害事象が引き起こされるため、現段階では推奨される標準治療は存在せず、化学療法は前向き臨床研究以外で行われるべきではない。
執筆:独立行政法人国立病院機構 大阪医療センター 消化器内科 医師 長谷川 裕子先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生