| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 食道癌 | 二次治療 | 第2相 | 奏効割合/安全性 | 国内 | あり |
試験名 : なし
レジメン:パクリタキセル
登録期間:2006年6月〜2007年7月
背景
5-FU+シスプラチン併用療法は切除不能食道癌の標準的一次化学療法と見なされているが、本レジメンに不応/不耐となった症例に対する標準的二次化学療法は確立されていない。
食道癌に対するパクリタキセルは、単剤でも、その他薬剤との併用療法でも、また局所進行例に対しては放射線照射との併用でも有効性が報告されている。併用療法に関しては、転移性症例に対しても良好な奏効割合を示したが、骨髄抑制、消化器毒性、神経障害といった有害事象を高頻度に生じた。
パクリタキセル毎週投与法は、乳癌や卵巣癌でその忍容性が報告されており、また24時間投与より1時間で投与した方が血液学的毒性が軽減されると報告されており、食道癌においてもパクリタキセル毎週投与法(80mg/m2)の忍容性と控えめな有効性が報告されている。
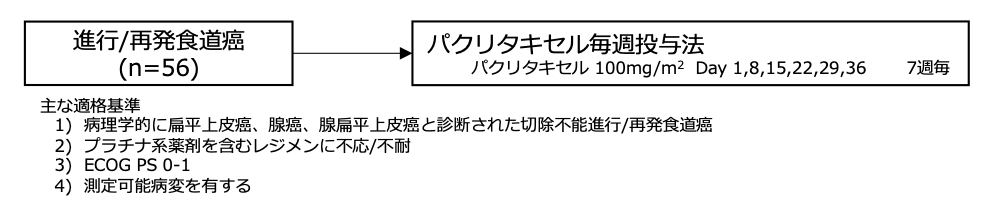
本邦で行われた固形癌を対象とするパクリタキセル毎週投与法(1時間投与/6週投与1週休薬)の第1相試験では、80-120mg/m2で用量が漸増され、用量制限毒性は認められなかった。しかし、120mg/m2で投与を受けた6例全例に末梢神経障害が出現し、4例が治療継続困難となった。そのため、100mg/m2が第2相試験の推奨用量と決定され、プラチナベースの化学療法に不応/不耐となった進行/再発食道癌におけるパクリタキセル毎週投与法(100mg/m2)の有効性と安全性を検討する本試験が開始された。
食道癌に対するパクリタキセルは、単剤でも、その他薬剤との併用療法でも、また局所進行例に対しては放射線照射との併用でも有効性が報告されている。併用療法に関しては、転移性症例に対しても良好な奏効割合を示したが、骨髄抑制、消化器毒性、神経障害といった有害事象を高頻度に生じた。
パクリタキセル毎週投与法は、乳癌や卵巣癌でその忍容性が報告されており、また24時間投与より1時間で投与した方が血液学的毒性が軽減されると報告されており、食道癌においてもパクリタキセル毎週投与法(80mg/m2)の忍容性と控えめな有効性が報告されている。
本邦で行われた固形癌を対象とするパクリタキセル毎週投与法(1時間投与/6週投与1週休薬)の第1相試験では、80-120mg/m2で用量が漸増され、用量制限毒性は認められなかった。しかし、120mg/m2で投与を受けた6例全例に末梢神経障害が出現し、4例が治療継続困難となった。そのため、100mg/m2が第2相試験の推奨用量と決定され、プラチナベースの化学療法に不応/不耐となった進行/再発食道癌におけるパクリタキセル毎週投与法(100mg/m2)の有効性と安全性を検討する本試験が開始された。
シェーマ
統計学的事項
主要評価項目:奏効割合/安全性
本試験は試験治療の期待奏効割合を15%、閾値奏効割合を5%と設定され、検出力80%、片側α=0.05として、52例の登録が必要と設定された。試験結果:
- 2006年6月から2007年7月の間に日本国内12施設より56例が登録された。
- 3例がスクリーニングからベースラインの間にヘモグロビン 9.0g/dLを下回り、試験治療開始前に脱落となったため、53例がパクリタキセルの投与を受けた。
- 1例が標的病変としていた病変が転移性病変ではなく、有効性の解析から除外された。
1. 患者背景
- 53例中、52例(98.1%)が扁平上皮癌であった。
- 前治療:外科的切除:24例(46.2%)、放射線照射:34例(65.4%)(化学放射線療法 30例(57.7%)を含む)、術前補助化学療法:7例(13.5%)、術後補助化学療法:14例(26.9%)
- 前化学療法中止理由:病勢進行 25例(48.1%)、再発:5例(9.6%)、有害事象:1例(1.9%)、予定治療の完遂:26例(50.0%)
2. 奏効割合 (主要評価項目)
| 症例数 | CR | PR | SD | PD | NE | 奏効割合 | 95%信頼区間 |
|---|---|---|---|---|---|---|---|
| 52 | 4 | 19 | 14 | 8 | 7 | 44.2% | 30.5-58.7 |
| 症例数 | CR | PR | SD | PD | NE | 奏効割合 | ||
|---|---|---|---|---|---|---|---|---|
| ECOG PS | 0 1 |
27 25 |
2 2 |
13 6 |
7 7 |
1 7 |
4 3 |
55.6 32.0 |
| 組織診断 | 腺癌 扁平上皮癌 |
1 51 |
0 4 |
1 18 |
0 14 |
0 8 |
0 7 |
100.0 43.1 |
| 進行/再発 | 再発 Stage IV |
31 11 |
0 4 |
16 3 |
10 4 |
6 2 |
5 2 |
48.8 27.3 |
| 化学放射線療法 | なし あり |
22 30 |
1 3 |
8 11 |
6 8 |
5 3 |
2 5 |
40.9 46.7 |
| 化学療法 | 5-FU+シスプラチン (+アドリアマイシン) |
47 | 3 | 17 | 14 | 7 | 6 | 42.6 |
| 無治療期間 | ≦6ヶ月 >6ヶ月 |
39 13 |
2 2 |
13 6 |
10 4 |
8 0 |
6 1 |
38.5 61.5 |
3. 投与状況
- 投与サイクル中央値:2サイクル(範囲:1-8)
- 投与回数中央値:10回(範囲:1-42)
- 初回減量までの期間中央値:84日
- 80mg/m2への減量:23例(43.4%)、60mg/m2への減量:7例(13.2%)
- 用量強度中央値:78.5mg/m2/週(範囲:39.8-100)・・・予想用量の90%を越えている
- 総投与期間中央値:3ヶ月(範囲:0.2-14.0)
4. 増悪までの期間/全生存期間
| N=52 | (観察期間中央値) | 中央値 | 95%信頼区間 |
|---|---|---|---|
| 増悪までの期間 | (3.9ヶ月) | 3.9ヶ月 | 2.8-4.6 |
| 全生存期間 | (9.1ヶ月) | 10.4ヶ月 | 7.8-14.2 |
- CR/PR症例(n=23)における奏効期間中央値:4.8ヶ月(95%信頼区間 3.2-7.1)
- CR例の1例はCR後、5.5ヶ月で病勢進行したが、残りの3例は病勢進行なく、6.9ヶ月以上の間、CRを維持していた。
5. 有害事象 (NCI-CTCAE ver.2.0)
| N (%) | 全Grade | Grade 3以上 |
|---|---|---|
| 白血球減少 | 43 (81.1) | 24 (45.3) |
| 好中球数減少 | 42 (79.2) | 28 (52.8) |
| 貧血 | 4 (7.5) | 2 (3.8) |
| 血小板数減少 | 6 (11.3) | 1 (1.9) |
| 発熱性好中球減少 | 2 (3.8) | 2 (3.8) |
| 悪心 | 23 (43.4) | 1 (1.9) |
| 便秘 | 15 (28.3) | 4 (7.5) |
| 下痢 | 15 (28.3) | 1 (1.9) |
| 口腔粘膜炎 | 13 (24.5) | 0 (0) |
| 嘔吐 | 13 (24.5) | 0 (0) |
| 食欲不振 | 26 (49.1) | 5 (9.4) |
| 疲労 | 38 (71.7) | 5 (9.4) |
| 発熱 | 18 (34) | 0 (0) |
| 筋肉痛 | 16 (30.2) | 0 (0) |
| 関節痛 | 15 (28.3) | 0 (0) |
| 末梢性感覚ニューロパチー | 43 (81.1) | 3 (5.7) |
| 肺炎 | 6 (11.3) | 4 (7.5) |
| 皮疹 | 15 (28.3) | 1 (1.9) |
- 1例が過敏反応(アナフィラキシーショック)を呈したが、適切な処置で回復し、治療中止となった。
- 全146サイクルの内、全Gradeの白血球減少は119サイクル(81.5%)、好中球数減少は118サイクル(80.8%)に生じた。白血球数と好中球数の最低値はそれぞれ2000/μL(範囲:800-2980)、957/μL(範囲:101-1463)であった。
- ほとんどの症例で白血球数と好中球数はGrade 1以下に回復し、回復までの期間中央値は白血球数が14日、好中球数が8.5日であった。
- 全15回の重篤な有害事象の内、パクリタキセル関連は12回であった。詳細:肺炎(n=4)、間質性肺疾患(n=3)、発熱性好中球減少(n=2)、腸閉塞(n=1)、過敏症(n=1)、帯状疱疹(n=1)、結核(n=1)、食欲不振(n=1)、呼吸不全(n=1)
- 1例でパクリタキセルに関連した4つの重篤な血液学的有害事象(貧血・好中球数減少・白血球減少・血小板数減少)を生じた。
- 治療関連死亡はなかった。
- 有害事象で治療中止となった症例は18例(34.0%)であり、高頻度の事象は骨髄抑制(n=3)、感覚神経障害(n=3)であった。有害事象でパクリタキセルの減量至った症例は23例(43.4%)であり、高頻度の事象は感覚神経障害(n=10, 18.9%)であった。有害事象により投与スキップ/投与延期につながったのは126サイクル(19.6%)/21サイクル(22.6%)であり、高頻度の事象は好中球数減少(n=28, 52.8%)であった。
結語
本試験の結果、プラチナ製剤に不応/不耐の切除不能進行/再発食道癌患者に対するパクリタキセル毎週投与法の有効性と忍容性が示され、有用な治療オプションの1つになるものと考えられた。
執筆:香川大学医学部附属病院 腫瘍内科 助教 大北 仁裕 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生