| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 肝細胞癌 | 一次治療 | 第3相 | 全生存期間 | 国際 | あり |
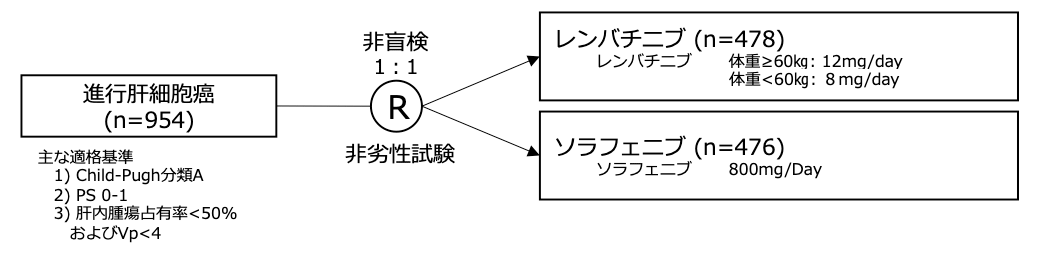
試験名: REFLECT
レジメン: レンバチニブ vs ソラフェニブ
試験期間: 2013年3月〜2015年7月
シェーマ
統計学的事項
主要評価項目:全生存期間
本試験は、ソラフェニブ群を対照としてレンバチニブ群の全生存期間のハザード比が0.80となることを検証することを目的とし、非劣性マージンの上限を1.08とした非劣性試験であると同時に、優越性も検証するよう設計され、非劣性の検出力97%、優越性の検出力82%、全体の両側α=0.05として、954例の登録・700イベントが必要と設定された。試験結果:
- 2013年3月から2015年7月の間に、20ヶ国から954例が登録された。
- データカットオフは2016年11月、観察期間中央値は27.7ヶ月であった。
- 患者背景は、両群に大きな隔たりはなかったが、AFP高値群はレンバチニブ群にやや多い傾向にあった。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.92 (95%C.I. 0.79-1.06) | |
| レンバチニブ | 13.6ヶ月 | 12.1-14.9 | |
| ソラフェニブ | 12.3ヶ月 | 10.4-13.9 |
レンバチニブは、ソラフェニブに対して全生存期間の非劣性を示した。
本試験は、過去10年間行われてきたソラフェニブに対する全生存期間を主要評価項目とした試験で、初めて非劣性を証明した国際第3相試験となった。
2. 無増悪生存期間(mRECIST, 主治医による判定)
| 中央値 | 95%信頼区間 | HR 0.66 (95%C.I. 0.57-0.77) p<0.0001 |
|
| レンバチニブ | 7.4ヶ月 | 6.9-8.8 | |
| ソラフェニブ | 3.7ヶ月 | 3.6-4.6 |
3. 奏効割合(RECIST ver1.1, 中央判定)
| 奏効割合 | OR 3.34 (95%C.I. 2.17-5.14) p<0.0001 |
|
| レンバチニブ | 18.8% | |
| ソラフェニブ | 6.5% |
4. 奏効割合(mRECIST, 中央判定)
| 奏効割合 | OR 5.01 (95%C.I. 3.59-7.01) p<0.0001 |
|
| レンバチニブ | 40.6% | |
| ソラフェニブ | 12.4% |
5. 有害事象(NCI CTCAE ver.4.0)
| レンバチニブ(n=476) | ソラフェニブ(n=475) | |||
|---|---|---|---|---|
| 全Grade | Grade 3以上 | 全Grade | Grade 3以上 | |
| 手掌・足底発赤知覚不全症候群 | 128 (27%) | 14 (3%) | 249 (52%) | 54 (11%) |
| 下痢 | 184 (39%) | 20 (4%) | 220 (46%) | 20 (4%) |
| 高血圧 | 201 (42%) | 111 (23%) | 144 (30%) | 68 (14%) |
| 食欲不振 | 162 (34%) | 22 (5%) | 127 (27%) | 6 (1%) |
| 体重減少 | 147 (31%) | 36 (8%) | 106 (22%) | 14 (3%) |
| 疲労 | 141 (30%) | 18 (4%) | 119 (25%) | 17 (4%) |
結語
本試験の結果、レンバチニブは進行肝細胞癌に対する一次化学療法として、ソラフェニブに対する全生存期間の非劣性を示した。
レンバチニブの安全性および忍容性は、過去の報告と同様であった。
レンバチニブの安全性および忍容性は、過去の報告と同様であった。
執筆:神奈川県立がんセンター 消化器内科 肝胆膵 医長 小林 智 先生
監修:神奈川県立がんセンター 消化器内科 肝胆膵 医長 上野 誠 先生
監修:神奈川県立がんセンター 消化器内科 肝胆膵 医長 上野 誠 先生