| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 肝細胞癌 | 二次治療 | 第3相 | 全生存期間 | 国際 | あり |
試験名 :RESORCE
レジメン:レゴラフェニブ vs プラセボ
登録期間:2013年5月〜2016年2月
背景
肝細胞癌の薬物療法において、ソラフェニブ登場後、10年にわたり、第3相試験でpositiveを示す薬剤は認められなかった。特に、ソラフェニブ後の二次治療はアンメットニーズであった。レゴラフェニブは、血管新生阻害作用を持つチロシンキナーゼ阻害薬であり、大腸癌やGISTで承認されていた。第2相試験にて有効性が期待され、ソラフェニブ増悪例に対する第3相試験が計画された。
シェーマ
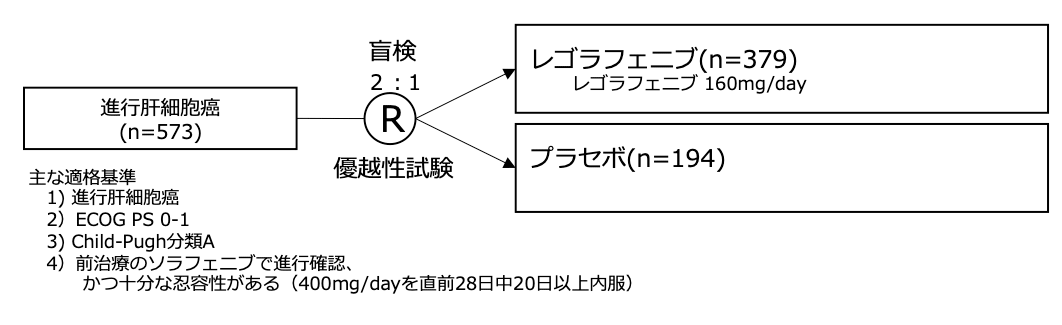
統計学的事項
主要評価項目:全生存期間
主要評価項目は全生存期間であり、レゴラフェニブの生存期間中央値11.4ヶ月、プラセボ群を8ヶ月と仮定し、ハザード比0.57、片側α=0.025、検出力90%、2:1の割り付けで370イベントが必要であり、560例の登録を予定した。試験結果:
- 2013年5月から2015年12月に573例が登録された。
- 6例が治療を開始せず、安全性の解析は567例で行われた。
- データカットオフは2016年2月、373イベントの時点で行われた。
- 患者背景に大きな隔たりは認めなかった。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | |
|---|---|---|
| レゴラフェニブ(n=379) | 10.6ヶ月 | 9.1-12.1 |
| プラセボ(n=194) | 7.8ヶ月 | 6.3-8.8 |
| HR 0.63 (95%C.I. 0.50-0.79) P<0.0001 |
||
2. 無増悪生存期間
| 中央値 | 95%信頼区間 | |
|---|---|---|
| レゴラフェニブ(n=379) | 3.1ヶ月 | 2.8-4.2 |
| プラセボ(n=194) | 1.5ヶ月 | 1.4-1.6 |
| HR 0.45 (95%C.I. 0.37-0.56) P<0.0001 |
||
3. 有害事象(CTEAE ver.4.03)
| レゴラフェニブ(n=374) | プラセボ(n=193) | |||||
|---|---|---|---|---|---|---|
| 全Grade | Grade 3 | Grade 4 | 全Grade | Grade 3以上 | Grade 4 | |
| 手足皮膚反応 | 52% | 13% | NA | 7% | 1% | NA |
| 下痢 | 33% | 2% | 0 | 9% | 0 | 0 |
| 疲労 | 29% | 6% | NA | 19% | 2% | NA |
| 高血圧 | 23% | 13% | <1% | 5% | 3% | 0 |
| 食欲不振 | 24% | 3% | 0 | 6% | 0 | 0 |
結語
レゴラフェニブは,ソラフェニブ後の二次治療としてプラセボを対照とした第3相試験において全生存期間を有意に延長することを示した初の薬剤である(ソラフェニブとレゴラフェニブは,類似の化学構造式をもつことから,有害事象が類似することが想定されたため,一次治療としてのソラフェニブで明らかな進行を認め,かつ十分に忍容性が確認された症例のみが登録された)。
執筆:千葉大学病院 臨床試験部 特任助教 小笠原 定久 先生
監修:神奈川県立がんセンター 消化器内科(肝胆膵) 部長 上野 誠 先生
監修:神奈川県立がんセンター 消化器内科(肝胆膵) 部長 上野 誠 先生